摘要: 氧化还原反应的实质 ,氧化还原反应规律:质量守恒定律: 和电子守恒定律: .置换反应全是氧化还原反应.复分解反应全部不是氧化还原反应.化合和分解反应一部分不都是氧化还原反应.
网址:http://m.1010jiajiao.com/timu3_id_192364[举报]
氧化还原反应的实质是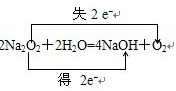
 .
.
查看习题详情和答案>>
电子的得失或电子对偏移
电子的得失或电子对偏移
;元素的化合价降低,发生的是还原
还原
反应;氧化还原反应中,还原剂失
失
电子(填“得”或“失”);试写出Na2O2与H2O反应的化学方程式,并用双线桥标出电子转移的方向和数目:

氧化还原反应中实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:
2NO3-+10H++8e-→N2O+5H2O
Fe2(SO4)3、KMnO4、Na2CO3、FeSO4四种物质中的一种物质能使上述还原过程发生.
(1)写出该氧化还原反应的离子方程式:
(2)该反应中氧化剂和还原剂物质的量之比为
(3)反应中硝酸体现了
(4)反应中若产生0.2mol气体,则转移电子的物质的量是
查看习题详情和答案>>
2NO3-+10H++8e-→N2O+5H2O
Fe2(SO4)3、KMnO4、Na2CO3、FeSO4四种物质中的一种物质能使上述还原过程发生.
(1)写出该氧化还原反应的离子方程式:
8Fe2++2NO3-+10H+=8Fe3++N2O+5H2O
8Fe2++2NO3-+10H+=8Fe3++N2O+5H2O
;(2)该反应中氧化剂和还原剂物质的量之比为
1:4
1:4
;(3)反应中硝酸体现了
氧化性
氧化性
、酸性
酸性
性质;(4)反应中若产生0.2mol气体,则转移电子的物质的量是
1.6mol
1.6mol
.