摘要:O2+4H++4e-==2H2O 2H2+4OH--4e-==4H2O 第三课时 电能转化为化学能 巩固练习
网址:http://m.1010jiajiao.com/timu3_id_192172[举报]
航天技术上使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点.氢-氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式可表示为2H2+O2=2H2O.酸式燃料电池的电解质是酸,其负极反应可表示为:2H2-4e-=4H+,则其正极反应式可表示为:
查看习题详情和答案>>
O2+4H++4e-═2H2O
O2+4H++4e-═2H2O
;放电一段时间后电解质溶液的pH将变大
变大
(填“变大、变小、不变”)碱式氢-氧燃料电池中的电解质是碱,其正极反应式为:O2+2H2O+4e-=4OH-,则其负极反应可表示为:2H2+4OH--4e-=4H2O
2H2+4OH--4e-=4H2O
.燃料电池是燃料(例如CO、H2、CH4等)跟氧气或空气反应,将此反应的化学能转化为电能的装置,电解质通常是KOH溶液,则下列关于甲烷燃料电池的说法正确的是( )
| A、负极反应式为:CH4+10OH--8e-═CO32-+7H2O | B、正极反应式为:O2+4H++4e-═2H2O | C、随着反应地进行,KOH溶液物质的量浓度不变 | D、该电池的总反应与甲烷燃烧的反应方程式相同,反应式为:CH4+2O2═CO2+2H2O |
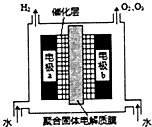 臭氧是常见的强氧化剂,广泛用于处理.制取臭氧的方法之一是电解纯水(原理如下图).电极b反应如下:3H2O→O3↑+6H++6e-;2H2O→O2↑+4H++4e-.
臭氧是常见的强氧化剂,广泛用于处理.制取臭氧的方法之一是电解纯水(原理如下图).电极b反应如下:3H2O→O3↑+6H++6e-;2H2O→O2↑+4H++4e-.下列说法不正确的是( )
查看习题详情和答案>>
(2010?烟台一模)(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液.电池总反应为:N2H4+O2=N2+2H2O.下列关于该燃料电池工作时的说法正确的是( )
查看习题详情和答案>>
 (2012?东城区一模)臭氧是一种强氧化剂,常用于消毒、灭菌等.
(2012?东城区一模)臭氧是一种强氧化剂,常用于消毒、灭菌等.(1)已知O3与KI溶液反应的生成物中有两种单质,其离子反应方程式为
O3+2I-+H2O=O2+I2+2OH-
O3+2I-+H2O=O2+I2+2OH-
.(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示.
已知:O3的起始浓度为0.0216mol/L.
pH t/min T/℃ |
3.0 |
4.0 |
5.0 |
6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
OH-
OH-
.②在30℃、pH=4.0条件下,O3的分解速率为
1.00×10-4
1.00×10-4
mol/(L?min).③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为
b、a、c
b、a、c
.(填字母代号)a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0
(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得.
①图中阴极为
A
A
(填“A”或“B”),其电极反应式为2H++2e-═H2↑
2H++2e-═H2↑
.②若C处通入O2,则A极的电极反应式为
O2+4H++4e-═2H2O
O2+4H++4e-═2H2O
.