摘要:A.B.C.D.E.F.G为由七种短周期元素构成的粒子.它们都 有10个电子.其结构特点如下表: 粒子代号 A B C D E F G 原子核数 单核 单核 双核 多核 单核 多核 多核 电荷数 0 1+ 1- 0 2+ 1+ 0 其中.B的离子半径大于E的离子半径,D是由极性键构成的4原子极性分子,C常用作F的检验.请填写下列空白: (1) A粒子的结构示意图 . (2) 比较BC和EC2的碱性强弱BC EC2. (3) F与C反应的离子方程式
网址:http://m.1010jiajiao.com/timu3_id_191892[举报]
短周期元素A、B、C、D、E、F、G原子序数依次递增,已知A和D,C和G为同一主族元素,D形成的阳离子和C形成的阴离子具有相同的核外电子排布,B原子的最外层电子数比次外层多3,G形成的化合物甲是造成酸雨的主要原因,F和A可形成化合物FA4很不稳定(其中F显正价),F与C形成的化合物是制造光导纤维的主要原料,E的最高价氧化物的水化物能溶解于D的最高价氧化物的水化物中。请回答下列问题:
(1)写出B在周期表中的位置_______;画出G离子的结构示意图________。
(2)由C、D形成的一种淡黄色固体的电子式__________________。
(3)写出E的最高价氧化物的水化物溶解于D的最高价氧化物的水化物的离子方程式:_________________________。
(4)F和C形成的晶体微粒间的相互作用力是____________。
(5)化合物甲的治理方法之一是用软锰矿浆(主要成分为MnO2)吸收法,该方法能做到“综合治理、变废为宝”,请写出其反应的化学方程式_____________________ 。
(6)已知一包白色晶体为某种正盐,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀经过滤、洗涤、干燥后,称得质量为4.66g
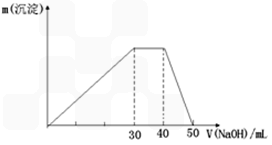
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,得到的沉淀和滴加的氢氧化钠溶液体积的关系如下图:则该正盐的化学式为________________ ;该物质可以用作为净水剂,其原理为____________________。(用离子方程式表示)
(1)写出B在周期表中的位置_______;画出G离子的结构示意图________。
(2)由C、D形成的一种淡黄色固体的电子式__________________。
(3)写出E的最高价氧化物的水化物溶解于D的最高价氧化物的水化物的离子方程式:_________________________。
(4)F和C形成的晶体微粒间的相互作用力是____________。
(5)化合物甲的治理方法之一是用软锰矿浆(主要成分为MnO2)吸收法,该方法能做到“综合治理、变废为宝”,请写出其反应的化学方程式_____________________ 。
(6)已知一包白色晶体为某种正盐,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀经过滤、洗涤、干燥后,称得质量为4.66g
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,得到的沉淀和滴加的氢氧化钠溶液体积的关系如下图:则该正盐的化学式为________________ ;该物质可以用作为净水剂,其原理为____________________。(用离子方程式表示)
A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都 有10个电子,其结构特点如下表:
其中,B的离子半径大于E的离子半径;D是由极性键构成的4原子极性分子;C常用作F的检验(加热).请填写下列空白:
(1)A粒子的结构示意图
 .
.
(2)比较BC和EC2的碱性强弱BC
(3)F与C反应的离子方程式
查看习题详情和答案>>
| 粒子代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)A粒子的结构示意图


(2)比较BC和EC2的碱性强弱BC
>
>
EC2(填<、>、=).(3)F与C反应的离子方程式
NH4++OH-=NH3.H2O
NH4++OH-=NH3.H2O
.(4分)A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都有10个电子,其结构特点如下表:
| 粒子代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 4核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1— | 0 | 2+ | 1+ | 0 |
其中,B的离子半径大于E的离子半径;C常用作F的检验(加热)。请填写下列空白:
(1)A粒子的结构示意图 。
(2)比较BC和EC2的碱性强弱BC EC2(填< 、> 、= )。
(3)F与C反应的离子方程式
查看习题详情和答案>>