网址:http://m.1010jiajiao.com/timu3_id_191226[举报]
 (2013?烟台一模)【化学--物质结构与性质】
(2013?烟台一模)【化学--物质结构与性质】硒是一种非金属,可以用作光敏材料、电解锰行业催化剂.
(l)Se是元素周期表中第34号元素,其基态原子的核外电子排布式为
(2)根据价层电子对互斥理论,可以推知SeO3的分子空间构型为
(3)CSe2与CO2结构相似,CSe2分子内σ键与π键个数之比为
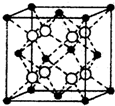
(4)硒化铷晶体属于反萤石型结构,晶胞结构如图所示.每个晶胞中包含
(1)Ni是元素周期表中第28号元素,基态Ni原子核外电子排布式为
(2)金属镍可以和CO形成配位化合物Ni(CO)n.
①CO与N2结构相似,CO分子内σ键与π键个数之比为
②已知配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=
(3)很多不饱和有机物在Ni的催化下可以与H2发生加成反应.如CH2=CH2、CH≡CH、苯、甲醛(H2C=O)等.
①有关苯分子中的化学键描述不正确的是
A.碳原子的三个sp2杂化轨道与其他原子形成的三个σ键
B.每个碳原子的未参加杂化的2p轨道用来形成大π键
C.每个碳原子的sp2杂化轨道中的一个用来形成大π键
D.苯分子中六个碳碳键完全相同,键角均为120°
②甲醛(H2C=O)分子内碳原子的杂化方式为
③甲醛(H2C=O)在Ni的催化作用下加氢可得甲醇(CH3OH).甲醇分子内碳原子的杂化方式为
硒是一种非金属,可以用作光敏材料、电解锰行业催化剂。
(l)Se是元素周期表中第34号元素,其基态原子的核外电子排布式为 。
(2)根据价层电子对互斥理论,可以推知SeO3的分子空间构型为 ,其中Se原子采用的轨道杂化形式为 。
(3)CSe2与CO2结构相似,CSe2分子内σ键与π键个数之比为 。CSe2首次是由H2Se与CCl4反应后制取的,CSe2分子内的Se—C—Se键角 (填“大于”,“等于”或“小于”)H2Se分子内的H—Se—H键角。
(4)硒化铷晶体属于反萤石型结构,晶胞结构如图所示。每个晶胞中包含 个Rb2Se单元,其中Se2-周围与它距离最近且相等的Rb+的离子数目为 。

查看习题详情和答案>>
(1)Ni是元素周期表中第28号元素,基态Ni原子核外电子排布式为______.第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是______(填元素符号).
(2)金属镍可以和CO形成配位化合物Ni(CO)n.
①CO与N2结构相似,CO分子内σ键与π键个数之比为______.
②已知配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=______.
(3)很多不饱和有机物在Ni的催化下可以与H2发生加成反应.如CH2=CH2、CH≡CH、苯、甲醛(H2C=O)等.
①有关苯分子中的化学键描述不正确的是______
A.碳原子的三个sp2杂化轨道与其他原子形成的三个σ键
B.每个碳原子的未参加杂化的2p轨道用来形成大π键
C.每个碳原子的sp2杂化轨道中的一个用来形成大π键
D.苯分子中六个碳碳键完全相同,键角均为120°
②甲醛(H2C=O)分子内碳原子的杂化方式为______,其分子构型为______.
③甲醛(H2C=O)在Ni的催化作用下加氢可得甲醇(CH3OH).甲醇分子内碳原子的杂化方式为______,甲醇分子内的O-C-H键角______(填“大于”、“等于”或“小于”)甲醛分子内的O-C-H键角.
查看习题详情和答案>>
(12分)下列三个反应在某密闭容器中进行:
反应① Fe(s)+CO2(g) FeO(s)+CO(g) △H1=" a" kJ·mol-1
FeO(s)+CO(g) △H1=" a" kJ·mol-1
反应② 2CO(g)+O2(g) 2CO2(g) △H2=" b" kJ·mol-1
2CO2(g) △H2=" b" kJ·mol-1
反应③ 2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1)则△H3= (用含a、b的代数式表示)
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则
a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有 (填序号)。
| A.缩小反应器体积 | B.再通入CO2 |
| C.升高温度 | D.使用合适的催化剂 |
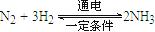 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显___________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。 查看习题详情和答案>>