摘要:18. (1)2Fe3++Cl2 =2Fe2++2Cl- , 红 沉淀生成,Fe(OH)3
网址:http://m.1010jiajiao.com/timu3_id_190978[举报]
某研究性学习小组为探究某医药公司出品的液体补血剂中的铁元素,进行了如下实验:
I.向试管中加入液体补铁剂2mL,加入蒸馏水,振荡后发现溶液变澄清透明;滴加KSCN溶液,溶液显示淡红色.学生甲认为此补血剂含铁量很低,属不合格产品.
(1)你认为学生甲的观点合理吗?
II.学生乙认为还应进一步探究实验,他将学生甲所得溶液分成三份,分别加入了氯水、溴水、碘水.发现加入氯水、溴水后溶液呈血红色,颜色明显加深,加入碘水的试管颜色无明显变化.请回答下列问题:
(2)根据乙的上述实验说明补血剂中的铁为
(3)向补血剂溶液中滴加KSCN溶液,显示淡红色的原因
(4)请写出加入氯水后对应的离子反应方程式
(5)请根据乙同学的实验现象进一步推断,氯、溴的单质可将铁单质氧化成
III.学生丙也做了与学生甲同样的实验,将所得的淡红色溶液分成两份继续进行实验:
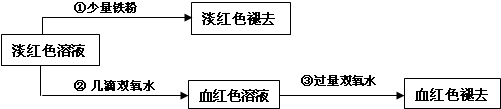
试回答下列问题:
(6)请写出丙的实验①中淡红色褪去的离子方程式
(7)关于③中的实验现象,丙同学提出了假设:过量的双氧水将SCN-氧化了.请你设计一个实验方案验证丙的假设
查看习题详情和答案>>
I.向试管中加入液体补铁剂2mL,加入蒸馏水,振荡后发现溶液变澄清透明;滴加KSCN溶液,溶液显示淡红色.学生甲认为此补血剂含铁量很低,属不合格产品.
(1)你认为学生甲的观点合理吗?
不合理
不合理
II.学生乙认为还应进一步探究实验,他将学生甲所得溶液分成三份,分别加入了氯水、溴水、碘水.发现加入氯水、溴水后溶液呈血红色,颜色明显加深,加入碘水的试管颜色无明显变化.请回答下列问题:
(2)根据乙的上述实验说明补血剂中的铁为
+2
+2
价.(3)向补血剂溶液中滴加KSCN溶液,显示淡红色的原因
有少量的亚铁离子被氧化.
有少量的亚铁离子被氧化.
.(4)请写出加入氯水后对应的离子反应方程式
Cl2+2Fe2+=2Cl-+2Fe3+
Cl2+2Fe2+=2Cl-+2Fe3+
.(5)请根据乙同学的实验现象进一步推断,氯、溴的单质可将铁单质氧化成
+3
+3
价铁,而Fe与I2反应的产物应该是FeI2
FeI2
.III.学生丙也做了与学生甲同样的实验,将所得的淡红色溶液分成两份继续进行实验:

试回答下列问题:
(6)请写出丙的实验①中淡红色褪去的离子方程式
Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
.(7)关于③中的实验现象,丙同学提出了假设:过量的双氧水将SCN-氧化了.请你设计一个实验方案验证丙的假设
取少量加入过量双氧水后的溶液,往其中加入过量KSCN溶液,若溶液变红则说明是过量的双氧水将SCN-氧化了
取少量加入过量双氧水后的溶液,往其中加入过量KSCN溶液,若溶液变红则说明是过量的双氧水将SCN-氧化了
. A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如右(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如右(部分反应中的水已略去).(1)若A为氯碱工业的产品,C为厨房中的用品.
①D的电子式是


②反应Ⅲ的离子方程式是
HCO3-+OH-=H2O+CO32-
HCO3-+OH-=H2O+CO32-
.③氯碱工业制备A的化学方程式是
2NaCl+2H2
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2
2NaOH+H2↑+Cl2↑
,其中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1mol KI转移电子0.6mol,则三种物质间反应的离子方程式是
| ||
3Cl2+6OH-+I-=6Cl-+IO3-+3H2O
3Cl2+6OH-+I-=6Cl-+IO3-+3H2O
.(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料.
①反应Ⅲ的离子方程式是
Cl2+2Fe2+=2Cl-+2Fe3+
Cl2+2Fe2+=2Cl-+2Fe3+
.②B可作净水剂,在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是
Fe3++3H2O Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
 Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体Fe3++3H2O Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
. Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体(2011?江苏)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3?6H2O)的工艺流程如下:
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2+O2
2SO3,该反应的平衡常数表达式为K=
;过量的SO2与NaOH溶液反应的化学方程式为
(2)酸溶及后续过程中均需保持盐酸过量,其目的是
(3)通氯气氧化后时,发生的主要反应的离子方程式为
查看习题详情和答案>>

回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2+O2
| ||
| △ |
| c2(SO3) |
| c(O2)c2(SO2) |
| c2(SO3) |
| c(O2)c2(SO2) |
SO2+NaOH=NaHSO3
SO2+NaOH=NaHSO3
.(2)酸溶及后续过程中均需保持盐酸过量,其目的是
提高铁元素的浸出率
提高铁元素的浸出率
、抑制Fe3+水解
抑制Fe3+水解
.(3)通氯气氧化后时,发生的主要反应的离子方程式为
Cl2+2Fe2+=2Cl-+2Fe3+
Cl2+2Fe2+=2Cl-+2Fe3+
;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为Cl2 HCl
Cl2 HCl
(写化学式).某研究性学习小组为探究某医药公司出品的液体补血剂中的铁元素,进行了如下实验:向试管中加入液体补铁剂2mL,加入蒸馏水,振荡后发现溶液变澄清透明;滴加KSCN溶液,溶液显示淡红色.
(1)向补血剂溶液中滴加KSCN溶液,显示淡红色的原因是:
(2)学生甲认为此补血剂含铁量很低,属不合格产品.你认为学生甲的观点合理吗?为什么?
(3)学生乙又作了进一步探究实验,他将上述所得溶液分成三份,分别加入了氯水、溴水、碘水.发现加入氯水、溴水后溶液呈血红色,颜色明显加深,加入碘水的试管颜色无明显变化.请写出加入氯水后对应的离子反应方程式
(4)请根据乙同学的实验现象进一步推断,Fe与I2反应的产物应该是
查看习题详情和答案>>
(1)向补血剂溶液中滴加KSCN溶液,显示淡红色的原因是:
有少量的亚铁离子被氧化
有少量的亚铁离子被氧化
.(2)学生甲认为此补血剂含铁量很低,属不合格产品.你认为学生甲的观点合理吗?为什么?
不合理
不合理
(3)学生乙又作了进一步探究实验,他将上述所得溶液分成三份,分别加入了氯水、溴水、碘水.发现加入氯水、溴水后溶液呈血红色,颜色明显加深,加入碘水的试管颜色无明显变化.请写出加入氯水后对应的离子反应方程式
Cl2+2Fe2+=2Cl-+2Fe3+
Cl2+2Fe2+=2Cl-+2Fe3+
.(4)请根据乙同学的实验现象进一步推断,Fe与I2反应的产物应该是
FeI2
FeI2
.电子工业上常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
(1)检验溶液中Fe3+存在的试剂是
(2)写出FeCl3溶液与金属铜发生反应的离子方程式
(3)除去FeCl2中混有的FeCl3,可加入
(4)除去FeCl3中混有的FeCl2,可加入
查看习题详情和答案>>
(1)检验溶液中Fe3+存在的试剂是
KSCN溶液
KSCN溶液
,证明Fe3+存在的现象是溶液变为血红色
溶液变为血红色
(2)写出FeCl3溶液与金属铜发生反应的离子方程式
2Fe3++Cu=Cu2++2Fe2+
2Fe3++Cu=Cu2++2Fe2+
(3)除去FeCl2中混有的FeCl3,可加入
Fe
Fe
,反应的离子方程式为2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
(4)除去FeCl3中混有的FeCl2,可加入
Cl2
Cl2
,反应的离子方程式为Cl2+2Fe2+=2Fe3+
Cl2+2Fe2+=2Fe3+
.