网址:http://m.1010jiajiao.com/timu3_id_190148[举报]
A、B、C、D为周期表中前三周期元素,A元素原子的次外层电子数是最外层电子数的1/2,B的阴离子核外只有一个电子层,C单质在标准状况下密度是1.43g?L―1,D元素的焰色反应呈黄色。将以上四种元素组成的结晶盐M 3.4 g加热反应至完全失去结晶水,其质量减少1.35 g,所得无水盐中C元素的质量分数为39%,将该无水盐与适量盐酸作用得到一种弱酸,再将所得弱酸完全燃烧可得0.9g水和1.12L标准状况下的CO2,已知这种弱酸的―个分子中共有32个质子。试回答:
(1)A、B、C、D四种元素各是什么元素:A、 B、 C、 D 。(填元素符号)
(2)结晶盐M的化学式为 。
查看习题详情和答案>>A、B、C、D为周期表上36号以前的元素,原子半径A<B,A是周期表中未成对电子数最多的元素,A、B同族,B、C同周期,D与A、B、C三元素既不同周期也不同族,C、D可形成离子化合物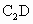 ,且两离子具有相同的电子层结构.请回答下列问题:
,且两离子具有相同的电子层结构.请回答下列问题:
(1)A原子的电子式:________
(2)B原子的原子结构示意图:________
(3)用电子式表示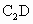 的形成过程:________
的形成过程:________
(4)B、D可形成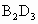 ,此化合物能被浓
,此化合物能被浓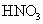 氧化,元素B和D均变成各自的最高价氧化物的水化物,同时有红棕色的气体
氧化,元素B和D均变成各自的最高价氧化物的水化物,同时有红棕色的气体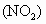 产生,该反应的化学方程式是:________
产生,该反应的化学方程式是:________
(1)当n=2时,AB2属于
(2)当n=3时,A与B形成的晶体属于
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是
(4)已知某红紫色配合物的组成为CoCl3?5NH3?H2O.该配合物中的中心离子钴离子在基态时核外电子排布式为
(1)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的多原子分子M、N、W,且在M、N、W分子中,A、B、C原子都采取sp3杂化。
①A、B、C的第一电离能由小到大的顺序为_____ (用元素符号表示)。A22-与C22+互为等电子体,C22+的电子式__________
②N的沸点比其同族相邻氢化物沸点高的主要原因是_____。W分子的空间构型的名称是_________
(2)E、F、G三元素的原子序数依次增大,它们原子的最外层电子排布均为4s1。
①F元素基态原子电子排布式为_____
②E元素单质的晶体堆积模型为_____(填字母)
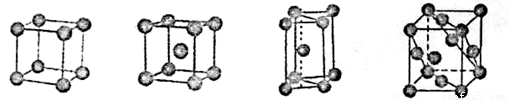
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
③向G的硫酸盐溶液中通入过量N气体,可生成[G(N)4]2+不考虑空间构型,[G(N)4]2+
的结构可用示意图表示为_____ (用元素符号表示)。
查看习题详情和答案>>
(1)当n=2时,AB2属于____分子(填“极性”或“非极性”)。分子中有 ____个σ键,____个π键。
(2)当n=3时,A与B形成的晶体属于_________晶体。该晶体与氢氟酸发生反应的化学方程式为____________________。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是____________(用元素符号表示)。
(4)已知某红紫色络合物的组成为CoCl3·5NH3·H2O,该络合物中的中心离子钻离子在基态时核外电子排布为_______,该物质中NH3通过______键与中心离子Co3+结合,NH3中N原子的杂化方式是_______。NH3
分子的空间构型为________。
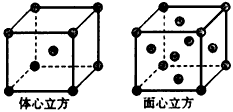
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,体心立方晶胞和面心立方晶胞中实际含有Fe原子的个数之比为____。