摘要:23.有A.B.C.D.E五种短周期元素(其中A.B.C.D为非金属元素).五种元素的原子序数按B.D.C.E.A顺序增大.D.C元素在周期表中位置相邻.在一定条件下.B可以分别和A.C.D化合生成甲.乙.丙化合物.甲.乙.丙三种化合物分别显酸性.中性和碱性. C单质和E单质化合可得淡黄色化合物丁.已知乙.丙两个分子中各含有10个电子.并且有如下的变化关系: 请填写下列空格: ⑴甲的浓溶液与一种黑色粉末共热可得A.该化学反应的离子方程式为: . ⑵写出下列化学用语: 用电子式表示乙分子的形成过程 . 戊分子的结构式: .甲和丙反应产物己的电子式: . C和E反应产物丁的电子式: . ⑶写出下列反应的化学方程式: 戊光照→甲+C: 丁和乙反应的化学方程式:
网址:http://m.1010jiajiao.com/timu3_id_190146[举报]
有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的名称:C
(2)写出A、B、C形成的化合物M的电子式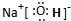
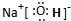 ;
;
(3)实验测得DE3 在熔融状态下不导电,则DE3 中含有的化学键类型为
(4)D单质与M的水溶液反应的离子方程式:
查看习题详情和答案>>
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C
钠
钠
,E氯
氯
;(2)写出A、B、C形成的化合物M的电子式
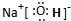
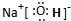
(3)实验测得DE3 在熔融状态下不导电,则DE3 中含有的化学键类型为
共价键
共价键
;(4)D单质与M的水溶液反应的离子方程式:
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.有A、B、C、D、E五种短周期元素,它们的核电荷数依次增大.其中:C、D是金属元素;A和C原子的最外层电子都只有一个;B和E原子的最外层电子数相同,且B原子L层电子数是K层电子数的3倍;D原子的最外层电子数是E原子最外层电子数的一半.由此推知:
(1)写出A、B、C、D、E五种元素的元素符号:A
(2)用电子式表示C、E两元素形成的化合物的过程:

(3)D的最高价氧化物对应水化物与NaOH反应的离子方程式:
查看习题详情和答案>>
(1)写出A、B、C、D、E五种元素的元素符号:A
H
H
BO
O
CNa
Na
DAl
Al
ES
S
(2)用电子式表示C、E两元素形成的化合物的过程:


(3)D的最高价氧化物对应水化物与NaOH反应的离子方程式:
Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
. 有A、B、C、D、E五种短周期元素,其原子序数依次增大.A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ?mol-1)分别为:578、1817、2745、11575.请回答下列问题:
有A、B、C、D、E五种短周期元素,其原子序数依次增大.A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ?mol-1)分别为:578、1817、2745、11575.请回答下列问题:(1)C、D两元素形成的化合物的晶体类型是
离子晶体
离子晶体
.BC2的结构式O=C=O
O=C=O
;(2)若F是D的同主族下一周期元素,则F的电子排布式是:
1S22S22P63S23P64S1
1S22S22P63S23P64S1
,(3)写出E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的离子方程式
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(4)A2C分子间因存在“氢键”的作用而彼此结合形成(A2C)n.在该分子形成的晶体中每个A2C分子被4个A2C分子包围形成变形的四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如图所示,试填空.
①含1molA2C的该晶体中有
2
2
mol“氢键”.②若G是C的同主族下一周期元素,请比较A2C与 A2G 沸点的高低
H2O>H2S
H2O>H2S
.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的名称:C
(2)E在元素周期表中的位置是
(3)B、C、D的简单离子半径由大到小的顺序是
(4)写出D单质与A、E形成的化合物的水溶液反应的离子方程式:
查看习题详情和答案>>
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 其阴离子带两个单位的负电荷,单质是空气主要成分之一 |
| C | 其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的1/4 |
| D | 其氢氧化物和氧化物都有两性,且与C同周期 |
| E | 与C同周期,其原子半径在该周期最小 |
(1)写出下列元素的名称:C
镁
镁
,E氯
氯
.(2)E在元素周期表中的位置是
三
三
周期ⅦA
ⅦA
族.(3)B、C、D的简单离子半径由大到小的顺序是
O2->Mg2+>Al3+
O2->Mg2+>Al3+
(用化学式表示).(4)写出D单质与A、E形成的化合物的水溶液反应的离子方程式:
2Al+6H+=2 Al3++3H2↑
2Al+6H+=2 Al3++3H2↑
. Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的| 3 | 4 |
(1)写出相应元素符合,A
H
H
BN
N
CO
O
ES
S
(2)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,在这种化合物的水溶液中,滴入紫色石蕊试液出现红色,则溶液中离子浓度由大到小的排列顺序为:
c(Na+)>c(HSO3-)>c(H+ )>c(SO32-)>c(OH-)
c(Na+)>c(HSO3-)>c(H+ )>c(SO32-)>c(OH-)
.(3)将铝片和镁片.插入由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为
2Al-6e-+8OH-=2AlO2-+4H2O
2Al-6e-+8OH-=2AlO2-+4H2O
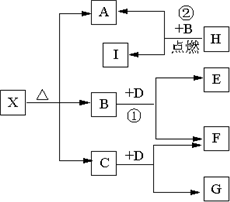
.Ⅱ(5分)已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系.
试回答下列问题
(1)G的化学式为:
NaOH
NaOH
.(2)写出下列反应的化学方程式
①
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
②2Mg+CO2  2MgO+C
2MgO+C
 2MgO+C
2MgO+C2Mg+CO2  2MgO+C
2MgO+C
. 2MgO+C
2MgO+C