网址:http://m.1010jiajiao.com/timu3_id_190069[举报]
2008年北京奥运会所用火炬燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷(C3H8),已知常温下1 mol丙烷燃烧放出2220 kJ热量,1 mol正丁烷燃烧放出2878kJ热量,1 mol异丁烷燃烧放出2869.6 kJ热量.试回答下列问题:
(1)表示正丁烷燃烧的热化学反应方程式________;
(2)下列有关说法正确的是________;
A.奥运火炬燃烧时的能量转化主要是由化学能转变为热能
B.相同条件下,正丁烷的热值比丙烷大
C.正丁烷比异丁烷不稳定
D.异丁烷分子中的碳氢键比正丁烷的多
(3)已知1 mol H2燃烧生成液态水放出热量是285.8 kJ,现有5 mol氢气和丙烷的混合气体,完全燃烧时放热3847kJ,则氢气和丙烷的体积比为________.
氮是大气中含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用,减少氮氧化物的排放是环境保护的重要内容之一。请回答下列氮及其化合物的相关问题:
(1)据报道,意大利科学家获得了极具研究价值的N4,其分子结构与白磷分子的正四面体结构相似。已知断裂1 mol N-N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量,请写出N4气体转变为N2反应的热化学方程式:______________________。
(2)据报道,NH3可直接用作车用燃料电池,写出该电池的负极反应式:
__________________________________________________________________________。
(3)在T1℃时,将5 mol N2O5置于10 L固定容积的密闭容器中发生下列反应:2N2O5(g) 4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
①上述平衡体系中O2的体积分数为__________,N2O5的物质的量为__________mol。
②用O2表示从0~5 min内该反应的平均速率υ(O2)= __________。
③将上述平衡体系的温度降至T2℃,密闭容器内减小的物理量有__________。
A.压强 B.密度 C.反应速率 D.N2O5的浓度
(4)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g) N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
A.都引起a减小 B.都引起a增大
C.充入NO2引起a减小,充入N2O4引起a增大
D.充入NO2引起a增大,充入N2O4引起a减小
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂1 mol N—N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则()
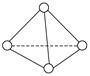
A.N4的熔点比P4高
B.1 mol N4气体转化为N2时要吸收724 kJ能量
C.N4是N2的同系物
D.1 mol N4气体转化为N2时要放出724 kJ能量
查看习题详情和答案>>
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂1 mol N—N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则()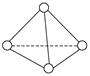
| A.N4的熔点比P4高 |
| B.1 mol N4气体转化为N2时要吸收724 kJ能量 |
| C.N4是N2的同系物 |
| D.1 mol N4气体转化为N2时要放出724 kJ能量 |

反应体系中各组分的部分性质见下表:
气体 | 氮气 | 氢气 | 氨 |
熔点/℃ | -210.01 | -252.77 | -77.74 |
沸点/℃ | -195.79 | -259.23 | -33.42 |
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程,即反应后通过把混合气体的温度降低到____________,使混合气体分离出产品,N2、H2继续循环。写出该反应的化学平衡常数表达式:K=____________。
(2)运用化学反应速率和化学平衡的观点说明工业上采用“使混合气体分离出产品,N2、H2继续循环”的生产措施的理由:___________________________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_____________________________。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图甲所示。下列叙述正确的是____________。
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图甲所示。下列叙述正确的是____________。
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值大
(5)1998年希腊亚里斯多德大学的Marncellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如下图乙。阴极的电极反应式为__________________________________________________________________。


甲 乙
查看习题详情和答案>>