网址:http://m.1010jiajiao.com/timu3_id_189868[举报]
下图表示各物质之间的转化关系(部分反应物没有给出)。
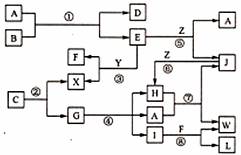
已知:
Ⅰ.A是无色液体,L是不溶于稀硝酸的白色沉淀,E、F、H、J、X、Y、Z是气体;
Ⅱ.G、X、Y、Z是单质,其他是化合物,其中Y呈黄绿色,H呈红棕色,E和F都极易溶于水,两者相遇有白烟生成;
Ⅲ.B和C都是由一种金属与一种非金属元素组成的化合物,其中非金属元素相同且质量分数都是28%,组成B金属元素原子核外的K层和M层电子数相同。
请按要求填空:
(1)写出下列物质A的电子式 ,X的结构式 ;
(2)工业上制取硝酸的反应有(填写反应代号): ;
(3)写出下列物质的化学式:B ,C ;
(4)反应④的化学方程式为: 。
(5)保持容器的温度和体积不变,在反应③刚好完全发生时,反应前后容器的压强之比为 。
查看习题详情和答案>>下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
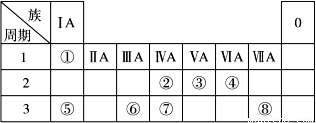
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②的最高价氧化物固态时的晶体类型:______________;⑦的最高价氧化物固态时的晶体类型:______________。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。若用球棍模型表示①和④形成的化合物的分子结构,应该是_____________。
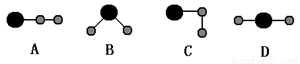
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是( )
A.最高正化合价为+6价, B.气态氢化物比H2S稳定,
C.最高价氧化物的水化物的酸性比硫酸弱, D.单质在常温下可与氢气化合。
(5) 已知X为ⅡA族元素(第一到第七周期),其原子序数为a,Y与X位于同一周期,且为ⅢA族元素,则Y的原子序数b与a所有可能的关系式___________________________。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
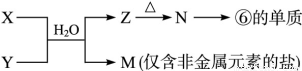
X溶液与Y溶液反应的离子方程式________, M中阳离子的鉴定方法____________。
查看习题详情和答案>>
(1)D与C形成一种含有两种化学键的离子化合物,写出该离子化合物的电子式:
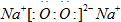
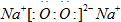
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应,请写出甲的结构式:
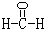
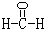
(3)由A、B两种元素组成的非极性分子有多种,其中一个分子含4个原子的为乙,已知乙的燃烧热为1300kJ/mol,乙燃烧的热化学反应方程式是:
| 1 |
| 2 |
| 1 |
| 2 |
如果用乙与C的单质在KOH作电解质溶液的条件下构成燃料电池,请写出其负极的电极反应式为:
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应的离子方程式是:
(5)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是
(6)E的一种氧化物与ClO-均具有漂白性,但两者混合后的产物均不具有漂白性,请写出该反应的离子方程式:
(21分)下表是元素周期表的一部分,回答有关问题。
|
|
ⅠА |
ⅡА |
ⅢА |
ⅣА |
ⅤА |
ⅥА |
ⅦА |
0 |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
③ |
④ |
⑤ |
⑥ |
|
⑦ |
⑧ |
⑨ |
|
4 |
⑩ |
11 |
|
|
|
|
12 |
|
(1)在这些元素中,最活泼的金属元素是(均用元素名称填写) —、最活泼的非金属元素是 、最不活泼的元素是
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是(均用化学式填写) 、碱性最强的是 ,呈两性的氢氧化物是 ,写出三者之间两两相互反应的离子方程式
(3)在这些元素中,原子半径最大的是 —、原子半径最小的是 (均用元素符号填写)
(4)写出②与④形成化合物的电子式 ;写出①单质的电子式 ;
查看习题详情和答案>>