摘要:下表是元素周期表的一部分.试回答下列问题: A B C D E F G H I J K L M N O (1)写出下列元素名称:B .N .O . (2)在这些元素中不属于主族元素的有 . (3)D.G.H的简单离子半径由大到小的顺序是 . (4)A与D可形成有较强氧化性的四原子分子.试写出这种分子的结构式 . (5)用电子式表示这些元素中金属性最强的元素与非金属性最强的元素之间形成的化合物的过程: . (6)B与H形成的化合物性质相似.试写出B的最高价氧化物水化物溶于J的氢化物水溶液反应的离子方程式 .
网址:http://m.1010jiajiao.com/timu3_id_188987[举报]
下表是元素周期表的一部分,回答下列问题:
(1)写出①、②两种元素的符号
(2)写出⑦、⑩两种元素的名称
(3)在这些元素中,
(4)这些元素的最高价氧化物的对应水化物中
(5)从③到⑨的元素中,
(6)比较④和⑤的化学性质
查看习题详情和答案>>
| I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
Be
Be
、O
O
(2)写出⑦、⑩两种元素的名称
硅
硅
、氩
氩
(3)在这些元素中,
Na
Na
(用元素符号填写,下同)是最活泼的金属元素;F
F
是最活泼的非金属元素;Ar
Ar
是最不活泼的元素.(4)这些元素的最高价氧化物的对应水化物中
HClO4
HClO4
(用化学式填写)酸性最强;NaOH
NaOH
(用化学式填写)碱性最强;能形成两性氢氧化物的元素是Al
Al
(用元素符号填写)(5)从③到⑨的元素中,
F
F
(用元素符号填写)原子半径最小.(6)比较④和⑤的化学性质
Na
Na
(用元素符号填写)更活泼,可用水
水
试剂验证.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
试回答下列问题: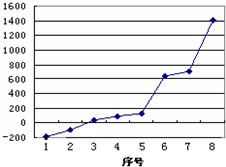
(1)请写出元素o的+3价阳离子基态电子排布式
(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
(3)由j原子跟d原子相互交替结合而形成一种坚硬难熔的晶体,该晶体中一个d原子与
(4)化合物kl2的中心原子杂化类型
查看习题详情和答案>>
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||

(1)请写出元素o的+3价阳离子基态电子排布式
1s22s22p63s23p63d5
1s22s22p63s23p63d5
.(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
Si
Si
(填元素符号);其中电负性最大的是2
2
(填右图中的序号).(3)由j原子跟d原子相互交替结合而形成一种坚硬难熔的晶体,该晶体中一个d原子与
3
3
个j原子成键,1mol该晶体中含12NA
12NA
个j-d键.(4)化合物kl2的中心原子杂化类型
sp3
sp3
,它在常温形成晶体时,属于分子
分子
晶体.下表是元素周期表的一部分,回答下列问题:

(1)写出②元素的名称
(2)在这些元素中,
(3)这些元素的最高价氧化物的对应水化物中
(4)从⑤到11的元素中,
(5)比较⑤与⑥的化学性质,
查看习题详情和答案>>

(1)写出②元素的名称
氮
氮
⑧元素的符号,Si
Si
.(2)在这些元素中,
Na
Na
(用元素符号填写,下同)是最活泼的金属元素;F
F
是最活泼的非金属元素;Ar
Ar
是最不活泼的元素.(3)这些元素的最高价氧化物的对应水化物中
HClO4
HClO4
酸性最强;NaOH
NaOH
碱性最强;两性氢氧化物是Al(OH)3
Al(OH)3
.写出以上能反应的化学方程式(至少二个):HClO4+NaOH=NaClO4+H20、NaOH+Al(OH)3=Na[Al(OH)4]、3HClO4+Al(OH)3=Al(ClO4)3+3H2O
HClO4+NaOH=NaClO4+H20、NaOH+Al(OH)3=Na[Al(OH)4]、3HClO4+Al(OH)3=Al(ClO4)3+3H2O
(4)从⑤到11的元素中,
Cl
Cl
原子半径最小(5)比较⑤与⑥的化学性质,
Na
Na
更活泼,试用实验证明此现象(简述操作、现象和结论)金属钠和金属镁的单质分别与冷水反应,反应剧烈程度打的是金属钠,反之是金属镁
金属钠和金属镁的单质分别与冷水反应,反应剧烈程度打的是金属钠,反之是金属镁
.(13分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素,试回答下列问题:
| A |
| R | |||||||||||||||
| B |
|
|
|
|
|
|
|
|
|
|
| C | D | E | F | T | |
| G | H | I | J |
| K | L |
| ||||||||||
|
|
|
|
|
| M |
| N |
|
|
|
|
|
|
|
|
|
|
(1)请写出G的淡黄色化合物与二氧化碳反应的方程式 。
(2)D的气态氢化物的VSEPR模型为 _ ,其中心原子的杂化类型为___ _ _ _ _ 。
(3)G、H和I的第一电离能数值由大到小的顺序为: (用元素符号作答)。
(4)由A、C、D形成的1mol ACD分子中,含有 个σ键, 个π键。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的
元素还有_______________(填元素符号),其中一种金属的晶胞结构如右
图所示,该晶胞中含有金属原子的数目为 。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2
是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有____________(填分子式)。
查看习题详情和答案>>