网址:http://m.1010jiajiao.com/timu3_id_188878[举报]
(20分)A物质是实验室一种无色有毒的挥发性液体,由X、Y两种短周期元素组成。A在空气中极易着火生成B气体和C气体;A不溶于水,但加热到423K可以和水反应,生成B气体和D气体,D只含两种元素,其中一种是Y。在交流放电的情况下,分解生成E气体、F固体两种物质,E物质和B化学式量几乎相等,含Y元素约72.7%;F是环状单质分子,具有冠状结构,易溶于A,F的式量约是C的4倍。E可在液氮条件下与HBr于77K生成含双键结构的物质G,冷却至室温可得G的环状三聚体H。
6-1 写出A、B、C、D、E、F、G、H的结构简式。
6-2 用X射线衍射法测得F的晶体为正交晶系,晶胞参数a=1048pm,b=1292pm,c=2455pm。已知该物质的密度为2.07g?cm-3。计算每个晶胞中F分子的数目。
6-3 自发现富勒烯以来,其神奇的结构和性能引起了人们对碳原子团簇广泛和深入的研究。除了碳原子团簇之外,其它元素的原子团簇是否也具有类似碳原子团簇的奇异的特性,这是个十分有趣的研究课题。F物质有很多同分异构体,在实验手段受到各种条件的限制时,理论研究是一种重要的补充。厦门大学化学系对F物质的原子团簇进行了理论计算,发现除了冠状结构外还有多种结构。其中一种X具有2次对称轴,以及两个包含对称轴的对称面,一配位和三配位原子数目相等;另外一种Y是一种椅式结构原子团簇增加2个原子形成,也具有二次对称轴,对称面和对称轴垂直。请画出这两种结构的原子团簇。
6-4 五氟化砷AsF5(2.93g)和上述物质F(0.37g)用四氮化四硫S4N4(0.53g)在液态SO2溶剂中发生完全的反应,溶剂和挥发性产物被泵抽出后得黄色固体残留物L(3.08g),分析J知其含有:As 28.04%,F 42.70%,N 5.25%,经分析L是离子化合物,阴离子为正八面体结构,阳离子为两种元素组成,结构是直线形。固体L(0.48g)溶于液态二氧化硫,和叠氮化铯Cs+N3-(0.31g)完全反应,收集应释放出得氮气于66.5kPa、298K为67.1cm3。反应混合物过滤得难溶蓝黑色纤维状固体J(0.16g)。分析J知其含有2种元素,其中含N 30.3%。红外光谱、X射线粉末衍射结果表明抽出SO2后残留物是六氟砷(V)酸铯。
(1)L的实验式是什么?
(2)提出L的结构式;
(3)写出配平的生成L的方程式;
(4)1mol L发生转化时生成氮气的物质的量;
(5)J的化学式;
(6)写出n mol L生成J的普遍离子方程式。
查看习题详情和答案>>(12分)A、B、C、D、E、F、G七种前四周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
(1)写出F元素基态原子的核外电子排布式 ;
(2)B、C、D三种元素电负性由大到小的顺序是 (用元素符号表示);
(3)下列有关上述元素的说法,正确的是 (填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为 ,1 mol B2A4分子中含有 molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是 。
说明:O摄氏度=273K
【解析】原子中没有成对电子只有氢元素,即A是H。基态原子中电子占据三种能量不同的原子轨道,说明这三种轨道分别是1s、2s和2p,又因为每种轨道中的电子总数相同,所以B是C。根据氢化物沸点变化趋势如图可判断,氢化物形成的晶体是分子晶体,但D的最高,沸点是100℃,说明氢化物中含有氢键,且D位于第二周期,故D是O。地壳中含量最高的金属元素是Al,即F是Al。G与F同主族,G的原子序数最大,则G是Ga。由于A、B、C、D、E、F、G的原子序数依次增大,所以C是N。
(1)Al的原子序数是13,所以基态原子的核外电子排布式1S22S22P63S23P1。
(2)电负性是用来描述不同元素的原子对键合电子吸引了的大小,非金属性越强,电负性越大。C、N、O均属于同一周期元素,原子序数逐渐增大,所以非金属性逐渐增强,即电负性大小顺序为O > N > C
(3)氨气中含有氢键所以其沸点高于甲烷的,①不正确。CCl4、苯等有机溶剂均属于非极性分子,根据相似相溶原理可判断Ni(CO)4应为分子晶体,②不正确。氨气分子中的中心原子有4对电子对,其中有1对孤电子对,所以空间构型是三角锥形,采用sp3杂化,③不正确。镁合铝是金属,形成的是金属晶体,金属原子半径越小,金属离子的电荷数越多,金属键越强,所以④正确。比G的原子序数少1的元素是锌,由于锌的核外电子均是全充满,稳定,所以其第一电离能要大于Ga,⑤正确。
(4)在CH2=CH2中含有4个C-H单键和1个碳碳双键,而双键又是又1个σ键和1个 键构成的,所以1mol乙烯中含有5molσ键。
键构成的,所以1mol乙烯中含有5molσ键。
(5)氧化镁和氯化钠均属于离子晶体,形成离子晶体的离子键越强,熔点越高。形成离子键的离子半径越小,离子所带电荷数越多,离子键越强,镁离子半径小于钠离子半径氧离子半径小于氯离子半径,所以氧化镁的熔点高于氯化钠的。
查看习题详情和答案>>
(12分)A、B、C、D、E、F、G七种前四周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
(1)写出F元素基态原子的核外电子排布式 ;
(2)B、C、D三种元素电负性由大到小的顺序是 (用元素符号表示);
(3)下列有关上述元素的说法,正确的是 (填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为 ,1 mol B2A4分子中含有 molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是 。
说明:O摄氏度=273K

【解析】原子中没有成对电子只有氢元素,即A是H。基态原子中电子占据三种能量不同的原子轨道,说明这三种轨道分别是1s、2s和2p,又因为每种轨道中的电子总数相同,所以B是C。根据氢化物沸点变化趋势如图可判断,氢化物形成的晶体是分子晶体,但D的最高,沸点是100℃,说明氢化物中含有氢键,且D位于第二周期,故D是O。地壳中含量最高的金属元素是Al,即F是Al。G与F同主族,G的原子序数最大,则G是Ga。由于A、B、C、D、E、F、G的原子序数依次增大,所以C是N。
(1)Al的原子序数是13,所以基态原子的核外电子排布式1S22S22P63S23P1。
(2)电负性是用来描述不同元素的原子对键合电子吸引了的大小,非金属性越强,电负性越大。C、N、O均属于同一周期元素,原子序数逐渐增大,所以非金属性逐渐增强,即电负性大小顺序为O > N > C
(3)氨气中含有氢键所以其沸点高于甲烷的,①不正确。CCl4、苯等有机溶剂均属于非极性分子,根据相似相溶原理可判断Ni(CO)4应为分子晶体,②不正确。氨气分子中的中心原子有4对电子对,其中有1对孤电子对,所以空间构型是三角锥形,采用sp3杂化,③不正确。镁合铝是金属,形成的是金属晶体,金属原子半径越小,金属离子的电荷数越多,金属键越强,所以④正确。比G的原子序数少1的元素是锌,由于锌的核外电子均是全充满,稳定,所以其第一电离能要大于Ga,⑤正确。
(4)在CH2=CH2中含有4个C-H单键和1个碳碳双键,而双键又是又1个σ键和1个 键构成的,所以1mol乙烯中含有5molσ键。
键构成的,所以1mol乙烯中含有5molσ键。
(5)氧化镁和氯化钠均属于离子晶体,形成离子晶体的离子键越强,熔点越高。形成离子键的离子半径越小,离子所带电荷数越多,离子键越强,镁离子半径小于钠离子半径氧离子半径小于氯离子半径,所以氧化镁的熔点高于氯化钠的。
查看习题详情和答案>>
短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
| X | Y | Z |
W |
|
|
|
(1)X元素在元素周期表中的位置___? __________。
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为_______________。
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为????????????????????????????? _。
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器____(填“能”或“不能”)用来腌制咸菜,原因是_________________________________________。
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式___________。

关于该电池的下列说法,正确的是______
A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性,能被酸性KMnO4氧化,请填写相应的离子,并给予配平: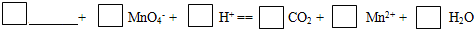 。
。
查看习题详情和答案>>
| | X | Y | Z |
| W | | | |
(1)X元素在元素周期表中的位置___ __________。
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为_______________。
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为 _。
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器____(填“能”或“不能”)用来腌制咸菜,原因是_________________________________________。
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式___________。

关于该电池的下列说法,正确的是______
A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:
 。
。