网址:http://m.1010jiajiao.com/timu3_id_188874[举报]
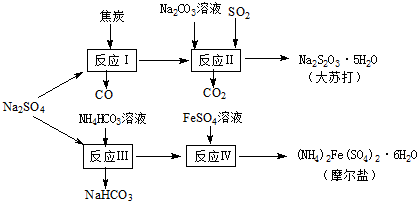 以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高.其主要流程如下:
以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高.其主要流程如下:试回答下列问题:
(1)已知反应Ⅰ中有Na2S生成,该反应的化学方程式为
(2)配平反应Ⅱ的化学方程式:
(3)反应Ⅲ温度需控制在35~40℃的较低温度,其主要原因是
(4)在摩尔盐溶液中加入一种物质的溶液可使NH4+、Fe2+、SO42-都大量减少,该物质是
(5)反应Ⅳ后,一般在酸性条件下结晶出摩尔盐,但如果该操作时间过长,摩尔盐中会因氧化而混有杂质,用离子方程式说明原因
①Na2SO4+4C
| 高温 |
②Na2SO4+4CO
| 高温 |
(1)现要制取Na2S 7.80g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4)
(2)若在反应中生成的Na2S物质的量为1mol,则消耗的碳单质的物质的量n的范围是
(3)若在上述反应中消耗的碳单质为1mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y=
| x+2 |
| 4+4x |
| x+2 |
| 4+4x |
(4)Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20g溶于水中,加入足量硫酸,充分反应后,过滤得沉淀9.6g,放出H2S气体1.12L(标准状况).请计算:39.20g样品中各成分的物质的量分别为
(请写出计算过程)
 (2011?宝鸡模拟)已知A、B、D、E中有一种元素相同,这些物质化学式中只含有这种元素的一
(2011?宝鸡模拟)已知A、B、D、E中有一种元素相同,这些物质化学式中只含有这种元素的一个原子,且E在C中可燃烧,火焰呈蓝紫色,A、B、D是白色固体,E是浅黄色固体,A、B、
D、E均不含结晶水,A、B、D其焰色反应呈黄色.
(1)写出下列物质的化学式:
A
(2)写出下列反应方程式(是离反应的写出离子方程式)
①C+D+H2O→E
(3)有一位同学把B放在封闭的容器中加热至恒重,试问恒重的固体物可能含有哪些物质?(可不写满或增加)
①
纯碱在日常生活和工业生产中用途广泛,需求量很大,因此纯碱的制备一直是科学家工作的一个重要方面。19世纪欧洲有个吕布兰制碱法,其主要反应原理是:
Na2SO4+2C![]() Na2S+2CO2↑
Na2S+2CO2↑
Na2S+CaCO3====CaS+Na2CO3
这种方法的最大缺点是:①此反应是高温固体反应,不能连续生产;②浪费原料,CO2不能回收利用;③污染环境,CaS没有任何用处,只能抛至野外。由于这些缺点的存在和后来化学工业的发展,吕布兰法被索尔维法代替。索尔维法的生产流程如下:

索尔维法能实现连续生产,但其食盐利用率只有75%,且所得副产品CaCl2没有用处,污染环境。
我国化学家侯德榜经过一年的努力,做了500多次循环实验,终于设计出新的制碱工艺,于1943年11月在完成实验室规模的流程实验基础上,在工厂顺利试产,食盐的利用率达96%以上,得到了纯碱和氯化铵两种重要产品。氯化铵主要用作氮肥。侯德榜制碱法原理是:
①在30~50 ℃的饱和食盐水中,先通入氨至饱和,再通入二氧化碳得到碳酸氢钠沉淀;
②过滤,将滤渣加热而得到产品;
③滤液中加入细食盐末,在10~15 ℃,使NH4Cl沉淀,滤液为饱和食盐水。
据此回答下列问题:
(1)标出反应Na2SO4+2C![]() Na2S+2CO2↑的电子转移方向和数目。
Na2S+2CO2↑的电子转移方向和数目。
(2)写出索尔维制碱法的各步反应的化学反应方程式:
①_________________________
②_________________________
③_________________________
④_________________________
(3)写出侯德榜制碱法第①步反应的化学方程式_________________________
(4)在索尔维制碱法中____________物质可循环利用。
(5)在侯德榜制碱法中____________物质可循环利用。
查看习题详情和答案>>(14分)硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在。
(1)已知:①Na2SO4(s)=Na2S(s)+2O2(g) ΔH1=+1011.0 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH3=-221.0 kJ·mol-1
则反应④Na2SO4(s)+4C(s)=Na2S(s)+4CO(g) ΔH4=________kJ·mol-1;工业上制备Na2S时往往还要加入过量的炭,同时还要通入空气,目的有两个,其一是使硫酸钠得到充分还原(或提高Na2S产量),其二是_____________________________________________。
(2)智能材料是当今材料研究的重要方向之一,纳米Fe3O4由于具有高的比表面、高的比饱和磁化强度和顺磁为零的超顺磁性而被广泛地用作磁流体的磁性粒子。水热法制备Fe3O4纳米颗粒的反应是:
3Fe2+ + 2S2O32- + O2 + xOH-=Fe3O4+S4O62-+2H2O
请回答下列问题:
①水热法所制得的水基磁流体超过30天都未出现分层和混浊现象,因为该分散系是________。
②上述反应方程式x=___________________。
③该反应中1molFe2+被氧化时,被Fe2+还原的O2的物质的量为_____。
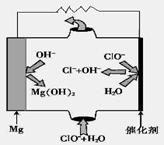
(3)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是____________。
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如上图,该电池反应的化学方程式为_____________________________________________________。
查看习题详情和答案>>