摘要:某学习小组探究催化剂二氧化锰的用量对反应速率的影响.他们做了这样一组实验:每次用30 mL 10%的过氧化氢溶液.采用不同量二氧化锰粉末做催化剂.测定各收集到500 mL氧气时所用的时间.结果如下: 实验次序 1 2 3 4 5 6 7 8 9 10 二氧化锰用量(g) 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0 时间(秒) 22 13 12 10 9 8 5 3 3 3 请分析表中数据.得出结论 : .
网址:http://m.1010jiajiao.com/timu3_id_18880[举报]
某兴趣小组同学对实验室制备氧气的若干问题进行如下实验探究.
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲同学设计以下对比实验:
Ⅰ.将2.45g KClO3与1.0g MnO2均匀混合加热
Ⅱ.将 x g KClO3与1.0g CuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢.通常采用的方法有:
①测相同时间内产生O2的体积
②测
Ⅰ中反应的文字表达式是
Ⅱ中x的值应为
(2)乙同学探究了影响双氧水分解速度的某种因素,实验数据记录如表:
【数据处理及结论】
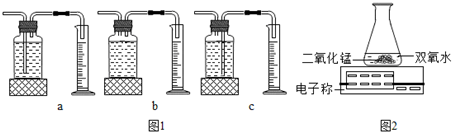
I.本实验中,测量O2体积的装置是
II.实验结论:在相同条件下,
III.丙用如图2装置进行实验,通过比较
(3)丙同学用KClO3和MnO2的混合物制取O2,完全反应后的固体残渣,经以下四步实验操作,回收得到了较纯净的MnO2(残渣中只有MnO2难于水).
他的正确操作先后顺序是
a.烘干 b.溶解 c.过滤 d.洗涤
步骤 c需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、
(4)丁同学在学习了质量守恒定律后,尝试计算了甲同学的实验中2.45g KClO3完全分解后生成O2的质量为
查看习题详情和答案>>
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲同学设计以下对比实验:
Ⅰ.将2.45g KClO3与1.0g MnO2均匀混合加热
Ⅱ.将 x g KClO3与1.0g CuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢.通常采用的方法有:
①测相同时间内产生O2的体积
②测
收集相同体积O2所需的时间
收集相同体积O2所需的时间
;Ⅰ中反应的文字表达式是
氯酸钾
氯化钾+氧气
| 二氧化锰 |
| 加热 |
氯酸钾
氯化钾+氧气
;| 二氧化锰 |
| 加热 |
Ⅱ中x的值应为
2.45
2.45
.(2)乙同学探究了影响双氧水分解速度的某种因素,实验数据记录如表:
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2的体积 | |
| I | 50.0g | 1% | 0.1g | 9mL |
| II | 50.0g | 2% | 0.1g | 16mL |
| III | 50.0g | 4% | 0.1g | 31mL |
I.本实验中,测量O2体积的装置是
c
c
(选填图1中“a”“b”“c”编号).
II.实验结论:在相同条件下,
双氧水浓度越大
双氧水浓度越大
,双氧水分解速率越快.III.丙用如图2装置进行实验,通过比较
相同时间天平读数差值大小(或电子称上示数减小的速度)
相同时间天平读数差值大小(或电子称上示数减小的速度)
也能达到实验目的.(3)丙同学用KClO3和MnO2的混合物制取O2,完全反应后的固体残渣,经以下四步实验操作,回收得到了较纯净的MnO2(残渣中只有MnO2难于水).
他的正确操作先后顺序是
bcda
bcda
(填写选项符号).a.烘干 b.溶解 c.过滤 d.洗涤
步骤 c需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、
玻璃棒
玻璃棒
,所填仪器在过滤操作中的作用是引流
引流
.(4)丁同学在学习了质量守恒定律后,尝试计算了甲同学的实验中2.45g KClO3完全分解后生成O2的质量为
0.96
0.96
g,标准状况下的O2体积为671.8
671.8
mL.(已知标准状况下,氧气密度为1.429g/L,结果精确到0.1mL)(无需写计算过程)某研究性学习小组选择“H2O2生成(O2)的快慢与什么因素有关“的课题进行探究,以下是他们探究的主要过程:
【查阅资料】H2O2在常温下会分解成H2O和O2,在催化剂的作用下,分解速率增大.
【假设】1.H2O2生成O2的快慢与催化剂种类有关;
【假设】2.H2O2生成O2的快慢与催化剂用量有关.
| 实验编号 | 1 | 2 | 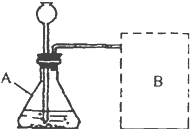 |
| 反应物 | 6%H202 | 6%H202 | |
| 催化剂 | lg红砖粉 | lgMnO2 | |
| 时间 | 152s | 35s |
【进行实验】如图是他们进行实验的装置图,气体发生装置中A仪器名称是________该实验中B处宜采用的气体收集方法是________.
【实验记录】
【结论1】该探究过程得出的结论是________.
【实验方案2】常温下,每次均用30mL10%的H2O2溶液,使用不同量的二氧化锰粉末作催化剂,测定每次收集到500ml氧气时所用的时间,结果如下(其他实验条件均相同):
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 二氧化锰粉末用量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间/s | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
某研究性学习小组选择“H2O2生成(O2)的快慢与什么因素有关“的课题进行探究,以下是他们探究的主要过程:
【查阅资料】H2O2在常温下会分解成H2O和O2,在催化剂的作用下,分解速率增大.
【假设】1.H2O2生成O2的快慢与催化剂种类有关;
【假设】2.H2O2生成O2的快慢与催化剂用量有关.
【实验方案1】常温下,在两瓶相同体积相同浓度的H2O2溶液中分别加入相同质量的MnO2和红砖粉,测量各生成一瓶湘同体积)O2所需要的时间.
【进行实验】如图是他们进行实验的装置图,气体发生装置中A仪器名称是______该实验中B处宜采用的气体收集方法是______.
【实验记录】
【结论1】该探究过程得出的结论是______.
【实验方案2】常温下,每次均用30mL10%的H2O2溶液,使用不同量的二氧化锰粉末作催化剂,测定每次收集到500ml氧气时所用的时间,结果如下(其他实验条件均相同):
【结论2】该探究过程得出的结论是______.
查看习题详情和答案>>
【查阅资料】H2O2在常温下会分解成H2O和O2,在催化剂的作用下,分解速率增大.
【假设】1.H2O2生成O2的快慢与催化剂种类有关;
【假设】2.H2O2生成O2的快慢与催化剂用量有关.
| 实验编号 | 1 | 2 | 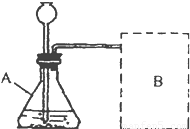 |
| 反应物 | 6%H22 | 6%H22 | |
| 催化剂 | lg红砖粉 | lgMnO2 | |
| 时间 | 152s | 35s |
【进行实验】如图是他们进行实验的装置图,气体发生装置中A仪器名称是______该实验中B处宜采用的气体收集方法是______.
【实验记录】
【结论1】该探究过程得出的结论是______.
【实验方案2】常温下,每次均用30mL10%的H2O2溶液,使用不同量的二氧化锰粉末作催化剂,测定每次收集到500ml氧气时所用的时间,结果如下(其他实验条件均相同):
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 二氧化锰粉末用量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间/s | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
查看习题详情和答案>>
归纳与演绎是重要的科学方法,也是常用的化学学习方法.
(1)我们已经学习过实验室制取O2、CO2、H2(Zn和稀硫酸反应)三种气体的反应原理、制取与收集方法.请你归纳出实验室制取气体反应的共同点 (填序号)
①需要加热 ②使用催化剂 ③没有气体参加反应 ④原料为纯净物 ⑤只生成一种气体
(2)下列是实验室常用的仪器
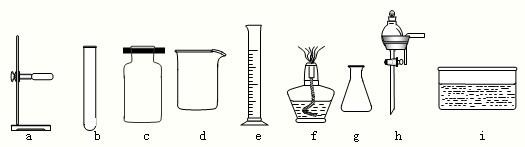
写出仪器名称:a是 ,c是 ;写出d的一种用途 .
(3)化学上可以通过多种反应制得NH3(极易溶于水,密度比空气小),例如
①2NH4Cl(固)+Ca(OH)2(固)
CaCl2+2NH3↑+2H2O
②NH4HCO3(固)
NH3↑+CO2↑+H2O
③CaO(固)+NH3.H2O(浓)═NH3↑+Ca(OH)2
我将选择反应 (只写一个,填序号)作为实验室制取氨气的反应原理.我需要用上面仪器中的 (填序号)来装配氨气发生装置(连接装置已经省略),我采用的收集方法是 .我选择的发生装置还可以用来制取 气体.
(4)某研究小组对用双氧水分解生成水和氧气的实验条件进行探究,完成了以下实验:
①往盛有5ml 5%H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5ml w% H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃.
③往盛有5ml w% H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②③中反应后试管中仍分别含有a gMnO2和 ag Fe2O3
研究小组还对溶液浓度、催化剂的种类等实验条件进行探究.下表选取了部分实验数据:用足量等体积H2O2溶液制取相同体积O2所需要的时间
查看习题详情和答案>>
(1)我们已经学习过实验室制取O2、CO2、H2(Zn和稀硫酸反应)三种气体的反应原理、制取与收集方法.请你归纳出实验室制取气体反应的共同点
①需要加热 ②使用催化剂 ③没有气体参加反应 ④原料为纯净物 ⑤只生成一种气体
(2)下列是实验室常用的仪器

写出仪器名称:a是
(3)化学上可以通过多种反应制得NH3(极易溶于水,密度比空气小),例如
①2NH4Cl(固)+Ca(OH)2(固)
| ||
②NH4HCO3(固)
| ||
③CaO(固)+NH3.H2O(浓)═NH3↑+Ca(OH)2
我将选择反应
(4)某研究小组对用双氧水分解生成水和氧气的实验条件进行探究,完成了以下实验:
①往盛有5ml 5%H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5ml w% H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃.
③往盛有5ml w% H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②③中反应后试管中仍分别含有a gMnO2和 ag Fe2O3
| 问题一:请你写出用双氧水和二氧化锰制氧气的化学反应方程式 问题二:MnO2和 Fe2O3在上述反应中的作用是 实验②④中的H2O2的浓度(w%)以 |
| 问题三:从左表中能得到哪些结论?(写出一条结论) |
| 浓度 时间(min) 条件 |
30%H2O2 | 15%H2O2 | 5%H2O2 |
| ag MnO2 | 0.2 | 0.8 | 2.0 |
| ag Fe2O3 | 0.7 | 9.0 | 16.0 |
归纳与演绎是重要的科学方法,也是常用的化学学习方法.
(1)我们已经学习过实验室制取O2、CO2、H2(Zn和稀硫酸反应)三种气体的反应原理、制取与收集方法.请你归纳出实验室制取气体反应的共同点______(填序号)
①需要加热 ②使用催化剂 ③没有气体参加反应 ④原料为纯净物 ⑤只生成一种气体
(2)下列是实验室常用的仪器

写出仪器名称:a是______,c是______;写出d的一种用途______.
(3)化学上可以通过多种反应制得NH3(极易溶于水,密度比空气小),例如
①2NH4Cl(固)+Ca(OH)2(固) CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
②NH4HCO3(固) NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
③CaO(固)+NH3.H2O(浓)═NH3↑+Ca(OH)2
我将选择反应______(只写一个,填序号)作为实验室制取氨气的反应原理.我需要用上面仪器中的______(填序号)来装配氨气发生装置(连接装置已经省略),我采用的收集方法是______.我选择的发生装置还可以用来制取______气体.
(4)某研究小组对用双氧水分解生成水和氧气的实验条件进行探究,完成了以下实验:
①往盛有5ml 5%H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5ml w% H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃.
③往盛有5ml w% H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②③中反应后试管中仍分别含有a gMnO2和 ag Fe2O3
| 问题一:请你写出用双氧水和二氧化锰制氧气的化学反应方程式 ______ 问题二:MnO2和 Fe2O3在上述反应中的作用是______. 实验②④中的H2O2的浓度(w%)以______为宜. |
| 问题三:从左表中能得到哪些结论?(写出一条结论) |
| 浓度 时间(min) 条件 | 30%H2O2 | 15%H2O2 | 5%H2O2 |
| ag MnO2 | 0.2 | 0.8 | 2.0 |
| ag Fe2O3 | 0.7 | 9.0 | 16.0 |