摘要:25.已知含有同一种元素的四种物质A.B.C.D 具有如右图所示的转化关系.其中A为单质.是工业上 合成氨的重要原料.则: (1)单质A的电子式是 .组成单质A的元素为X.X元素在周期表中位于第 周期 族.X的氢化物的结构式为 .请写出合成该氢化物的反应的化学方程式为 . (2)D物质的名称是 .D物质的浓溶液经常会略带黄色.请用化学方程式表示其原因 . (3)反应④中的还原剂是 .请写出反应④的离子方程式 . (4)生产.生活中B.C的大量排放会严重污染环境.任写一种B.C引起的环境问题 (5)请写出反应③的化学方程式 如右图.将一盛有纯净干燥的气体C的试管倒立于水中. 经过足够长的时间后.试管内水位上升的高度为试管高度 的 . 泉州七中08--09学年度下学期高一年期中考化学试卷 考试时间:90分钟 满分:100分 命卷人:陈昊萍 复核人:陈斐 第Ⅰ卷
网址:http://m.1010jiajiao.com/timu3_id_188457[举报]
(16分)已知含有同一种元素的四种物质A、B、C、D 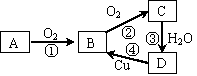 具有如右图所示的转化关系,其中A为单质,是工业上合成氨的重要原料,则:
具有如右图所示的转化关系,其中A为单质,是工业上合成氨的重要原料,则:
(1)单质A的电子式是 ,组成单质A的元素为X,X元素在周期表中位于第 周期 族,X的氢化物的结构式为 ,请写出合成该氢化物的反应的化学方程式为 。
(2)D物质的名称是 ,D物质的浓溶液经常会略带黄色,请用化学方程式表示其原因
(3)反应④中的还原剂是 ,请写出反应④的离子方程式 。
(4)生产、生活中B、C的大量排放会严重污染环境,任写一种B、C引起的环境问题
(5)如右图,将一盛有纯净干燥的气体C的试管倒立于水中,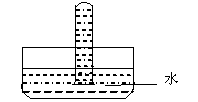 经过足够长的时间后,试管内水位上升的高度为试管高度的 ,若将盛有C 和O2混合气体的试管倒立于水中,经过足够长的时间后,试管内气体体积缩小为原体积的六分之一,则原混合气体中NO2和O2的体积比可能是 。
经过足够长的时间后,试管内水位上升的高度为试管高度的 ,若将盛有C 和O2混合气体的试管倒立于水中,经过足够长的时间后,试管内气体体积缩小为原体积的六分之一,则原混合气体中NO2和O2的体积比可能是 。
 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)(1)A、B、C、D的第一电离能由小到大的顺序为
Na<S<P<Cl
Na<S<P<Cl
.(2)C的氢化物分子是
极性
极性
(填“极性”或“非极性”)分子.(3)化合物BD3的分子空间构型是
三角锥形
三角锥形
.(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂.据此可判断E(CO)5的晶体类型为
分子晶体
分子晶体
;E(CO)5在一定条件下发生分解反应:E (CO)5═E (s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是金属键
金属键
.(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如图所示.体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为
1:2
1:2
.已知A、B、D、E四种物质中均含有同一种短周期元素,该元素原子的最外层电子数是内层电子数的3倍,D为气体单质,E为黑色粉末.如图转化关系中E均起催化作用(某些产物已略去). 则:
则:
(1)A的化学式为
 ;
;
(2)已知E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X.甲同学为探究该气体的性质,设计了如图装置(III中夹持装置已略去).

①I中发生反应的离子方程式为
②实验开始不久,观察到装置IV中的现象为
③实验结束后,该同学在装置III中观察到b的红色褪去,而没有出现“a无明显现象”这一预期现象.为达到实验目的,他在装置
(3)将气体X通入到紫色的石蕊试液中,观察到的现象是
(4)气体X能与溶液B反应,生成气体D,试写出该反应的化学方程式:
查看习题详情和答案>>
 则:
则:(1)A的化学式为
KClO3
KClO3
;B分子的电子式为

(2)已知E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X.甲同学为探究该气体的性质,设计了如图装置(III中夹持装置已略去).

①I中发生反应的离子方程式为
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
;
| ||
②实验开始不久,观察到装置IV中的现象为
溶液变蓝
溶液变蓝
;③实验结束后,该同学在装置III中观察到b的红色褪去,而没有出现“a无明显现象”这一预期现象.为达到实验目的,他在装置
装置II和III
装置II和III
(填装置序号)之间又添加了洗气瓶,该装置的作用是除去氯气中的水蒸气(或:干燥氯气)
除去氯气中的水蒸气(或:干燥氯气)
;(3)将气体X通入到紫色的石蕊试液中,观察到的现象是
紫色的石蕊试液先变红后褪色
紫色的石蕊试液先变红后褪色
;(4)气体X能与溶液B反应,生成气体D,试写出该反应的化学方程式:
Cl2+H2O2=2HCl+O2
Cl2+H2O2=2HCl+O2
.已知化合物A与B、丙与丁的元素组成相同,且四种物质中都含有同一种元素.A与B在常温下均呈液态.D与F都为固体单质,且D、F与甲的浓溶液在常温作用都无明显现象,加热时有大量气体产生.反应①除生成甲外,还生成丙.(相关转化部分反应条件和生成物未标出)

(1)A的化学式
 .
.
(2)写出反应①对应的化学方程式:
(3)写出过量D与甲稀溶液反应的离子方程式:
查看习题详情和答案>>

(1)A的化学式
H2O2
H2O2
,B的电子式

(2)写出反应①对应的化学方程式:
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.(3)写出过量D与甲稀溶液反应的离子方程式:
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
. 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)(1)A、B、C、D的第一电离能由小到大的顺序为
Na<S<P<Cl
Na<S<P<Cl
.(2)C的氢化物分子是
极性
极性
(填“极性”或“非极性”)分子.(3)化合物BD3的分子空间构型是
三角锥形
三角锥形
.(4)E元素原子的核外电子排布式是
1s22s22p63s23p63d64s2或[Ar]3d64s2
1s22s22p63s23p63d64s2或[Ar]3d64s2
;E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂.据此可判断E(CO)5的晶体类型为分子晶体
分子晶体
;E(CO)5中的配体CO与N2、CN-等互为等电子体,写出CO分子的结构式C≡O
C≡O
.(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示.体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为
1:2
1:2
.