摘要:Cu2S+2O22CuO+SO2.2CuS+3O2 2CuO+2SO2 [问题探究] (1)写出Cu与浓H2SO4反应的化学方程式 . (2)A试管上方的长导管的作用是 ,D.E两试管中CCl4的作用是 . (3)加热过程中.观察到A试管中出现大量白色烟雾.起初部分烟雾在试管上部内壁析出淡黄色固体物质.在持续加热浓硫酸时.淡黄色固体物质又慢慢地消失.写出淡黄色固体消失的化学反应方程式: . (4)对A试管中的浓H2SO4和铜丝进行加热.很快发现C试管中品红溶液褪色.但始终未见D试管中澄清石灰水出现浑浊或沉淀.学生1猜想是由于SO2溶解度较大.生成了Ca(HSO3)2的缘故.请你设计实验验证学生1的猜想 . (5)根据上述研究.结合资料卡上的内容.你认为液面下方铜丝表面的黑色物质成分是 .
网址:http://m.1010jiajiao.com/timu3_id_188294[举报]
辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质.研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰和碱式碳酸铜.主要工艺流程如下:
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4
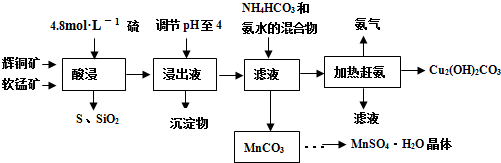
(1)实验室配制250mL 4.8mol?L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要
(2)酸浸时,为了提高浸取率可采取的措施有
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等.
写出该反应的化学方程式
(4)调节浸出液pH=4的作用是
(5)本工艺中可循环使用的物质是
(6)获得的MnSO4?H2O晶体后常用酒精洗涤,主要目的是
(7)用标准的BaCl2溶液测定样品中MnSO4?H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有
查看习题详情和答案>>
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4

(1)实验室配制250mL 4.8mol?L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要
250mL容量瓶
250mL容量瓶
、胶头滴管
胶头滴管
.(2)酸浸时,为了提高浸取率可采取的措施有
粉碎矿石(或适当升高温度或者搅拌)
粉碎矿石(或适当升高温度或者搅拌)
(任写一点).(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等.
写出该反应的化学方程式
Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S↓+4H2O
Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S↓+4H2O
.(4)调节浸出液pH=4的作用是
使Fe3+完全水解生成氢氧化铁沉淀
使Fe3+完全水解生成氢氧化铁沉淀
.(5)本工艺中可循环使用的物质是
NH3
NH3
(写化学式).(6)获得的MnSO4?H2O晶体后常用酒精洗涤,主要目的是
减少MnSO4?H2O晶体的损失
减少MnSO4?H2O晶体的损失
.(7)用标准的BaCl2溶液测定样品中MnSO4?H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有
混有硫酸盐杂质或部分晶体失去结晶水
混有硫酸盐杂质或部分晶体失去结晶水
(任写一种). (2013?临沂二模)研究硫及其化合物的性质有重要意义.
(2013?临沂二模)研究硫及其化合物的性质有重要意义.(1)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-773kJ?mol-1,当该反应有1.2mol电子转移时,反应释放出的热量为
77.3
77.3
kJ.(2)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g),SO2的平衡转化率与温度、压强的关系如图所示.
①压强:P1
<
<
P2(填“>”、“=”或“<”).②平衡常数:A点
=
=
B点(填“>”、“=”或“<”).③200℃下,将一定量的SO2和O2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
ab
ab
.a.SO2和O2的体积比保持不变
b.体系的压强保持不变
c.混合气体的密度保持不变
d.SO2和SO3物质的量之和保持不变
计算上述反应在0~10min内,υ(O2)=
0.08mol?L-1?min-1
0.08mol?L-1?min-1
.(3)一定温度下,用水吸收SO2气体时,溶液中水的电离平衡
向左
向左
移动(填“向左”“向右”或“不”);若得到pH=3的H2SO3溶液,试计算溶液中亚硫酸氢根离子和亚硫酸根离子浓度之比为| 1 |
| 6 |
| 1 |
| 6 |
辉铜矿主要成分是Cu2S,软锰矿主要成分是MnO2,它们都含有少量SiO2、Fe2O3等杂质.工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
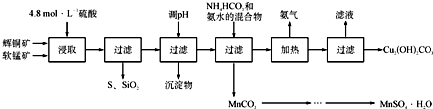
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算):
(1)酸浸时,为了提高浸取率可采取的措施有
(2)酸浸时,得到的浸出液中主要含有CuSO4、MnSO4等.写出该反应的化学方程式:
(3)调节浸出液pH的范围为
(4)本工艺中可循环使用的物质是
(5)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成
(6)用标准BaCl2溶液测定样品中MnSO4?H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有
查看习题详情和答案>>

已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算):
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe 3+ | 1.1 | 3.2 |
| Mn 2+ | 8.3 | 9.8 |
| Cu 2+ | 4.4 | 6.4 |
粉碎矿石(或适当升高温度或搅拌)
粉碎矿石(或适当升高温度或搅拌)
(任写一点).(2)酸浸时,得到的浸出液中主要含有CuSO4、MnSO4等.写出该反应的化学方程式:
2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O
2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O
.(3)调节浸出液pH的范围为
3.2≤PH<4.4;
3.2≤PH<4.4;
,其目的是使Fe3+离子转化为氢氧化铁沉淀除去
使Fe3+离子转化为氢氧化铁沉淀除去
.(4)本工艺中可循环使用的物质是
NH3
NH3
(写化学式).(5)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成
碱式碳酸铜减少
碱式碳酸铜减少
的结果.(6)用标准BaCl2溶液测定样品中MnSO4?H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有
混有硫酸盐杂质或部分晶体失去结晶水
混有硫酸盐杂质或部分晶体失去结晶水
(任写一种).(2004?上海)黄铜矿(主要成分CuFeS2)是提取铜的主要原料
(1)取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为
(2)已知2CuFeS2+4O2
Cu2S+3SO2+2FeO(炉渣)产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2→2Cu2O+2SO2;2Cu2O+Cu2S→6Cu+SO2;
假定各步反应都完全,完成下列计算:
①由6mol CuFeS2生成6mol Cu,求消耗O2的物质的量
②6mol CuFeS2和14.25mol O2反应,理论上可得到
③6mol CuFeS2和15.75mol O2反应,理论上可得到
查看习题详情和答案>>
(1)取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为
82.8%
82.8%
;(2)已知2CuFeS2+4O2
| 800℃ |
假定各步反应都完全,完成下列计算:
①由6mol CuFeS2生成6mol Cu,求消耗O2的物质的量
15mol
15mol
;②6mol CuFeS2和14.25mol O2反应,理论上可得到
4.5
4.5
摩尔铜;③6mol CuFeS2和15.75mol O2反应,理论上可得到
3
3
摩尔铜.