摘要:20.利用Na2O2与水反应能放出氧气的性质.可通过选择装置A或B来测定已部分变质的Na2O2样品中Na2O2的质量分数. (1)实验室提供的是500mL量筒.则实验中取用Na2O2样品的质量最合适的是 . A.0.1~0.2g B.2.5~3.0g C.5.0~6.0g D.10~15g (2)如图托盘天平称取样品.应选用下图中的 .不选用另一装置的原因是 . (3)因Na2O2与水反应会放热而影响测定的准确性.所以反应结束后.必须使锥形瓶中的气体温度恢复至室温.应选用装置A.B中的 .如果选用了另一种不适当的装置.测得的Na2O2的质量分数会 . (4)如在实验中.气体摩尔体积为a L·mol-1.量筒中收集到的水的体积为V mL.样品的质量为m g.则样品中Na2O2的质量分数为 .
网址:http://m.1010jiajiao.com/timu3_id_186850[举报]
利用Na2O2与水反应能放出氧气的性质,可通过选择装置A或B来测定已部分变质的Na2O2样品中Na2O2的质量分数。

(1)实验室提供的是500mL量筒,则实验中取用Na2O2样品的质量最合适的是_______。
A.0.1~0.2g B.2.5~3.0g C.5.0~6.0g D.10~15g
(2)如图托盘天平称取样品,应选用下图中的_________(填①或②)。不选用另一装置的原因是_______________。

(3)因Na2O2与水反应会放热而影响测定的准确性,所以反应结束后,必须使锥形瓶中的气体温度降低至室温,应选用装置A、B中的________(填A或B)。如果选用了另一种不适当的装置,测得的Na2O2的质量分数会________(填偏大或偏小),原因是___________。
(4)如在实验中,气体摩尔体积为a L?mol-1,量筒中收集到的水的体积为V mL,样品的质量为m g,则样品中Na2O2的质量分数为________________。
查看习题详情和答案>>某兴趣小组利用下图装置进行二氧化碳的制取和部分性质实验,回答下列问题: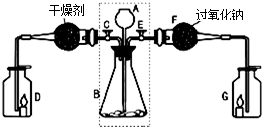
(1)关闭E打开C,从长颈漏斗A中加入液体与锥形瓶B中的固体接触,即有二氧化碳气体产生.观察到D中的蜡烛慢慢熄灭,说明二氧化碳具有
(2)关闭C打开E,观察到G中的蜡烛燃烧得更旺,说明有氧气生成.
[查阅资料]二氧化碳能与过氧化钠(Na2O2)反应生成碳酸钠和氧气.
[实验探究]要检验反应后F中的固体物质含有碳酸钠,可取少量反应后F中的固体物质于试管中,滴入
[实验结论]反应后F中的固体物质含有碳酸根离子.二氧化碳与过氧化钠反应的化学方程式为
[拓展联系]利用虚线框内装置还可以作为实验室制备
查看习题详情和答案>>

(1)关闭E打开C,从长颈漏斗A中加入液体与锥形瓶B中的固体接触,即有二氧化碳气体产生.观察到D中的蜡烛慢慢熄灭,说明二氧化碳具有
不燃烧,也不支持燃烧
不燃烧,也不支持燃烧
性质.写出实验室制取二氧化碳的化学方程式CaCO3+2HCl=CaCl2+CO2↑+H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
.(2)关闭C打开E,观察到G中的蜡烛燃烧得更旺,说明有氧气生成.
[查阅资料]二氧化碳能与过氧化钠(Na2O2)反应生成碳酸钠和氧气.
[实验探究]要检验反应后F中的固体物质含有碳酸钠,可取少量反应后F中的固体物质于试管中,滴入
稀盐酸
稀盐酸
,观察到有气泡产生;用蘸有澄清石灰水的玻璃片放在试管口,观察到玻璃片上出现白色固体
玻璃片上出现白色固体
,写出该反应的化学方程式Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
.[实验结论]反应后F中的固体物质含有碳酸根离子.二氧化碳与过氧化钠反应的化学方程式为
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
.[拓展联系]利用虚线框内装置还可以作为实验室制备
氢气
氢气
的发生装置,写出反应的化学方程式Zn+H2SO4=ZnSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
.某兴趣小组利用下图装置进行二氧化碳的制取和部分性质实验,回答下列问题:
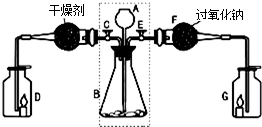
(1)关闭E打开C,从长颈漏斗A中加入液体与锥形瓶B中的固体接触,即有二氧化碳气体产生.观察到D中的蜡烛慢慢熄灭,说明二氧化碳具有______性质.写出实验室制取二氧化碳的化学方程式______.
(2)关闭C打开E,观察到G中的蜡烛燃烧得更旺,说明有氧气生成.
[查阅资料]二氧化碳能与过氧化钠(Na2O2)反应生成碳酸钠和氧气.
[实验探究]要检验反应后F中的固体物质含有碳酸钠,可取少量反应后F中的固体物质于试管中,滴入______,观察到有气泡产生;用蘸有澄清石灰水的玻璃片放在试管口,观察到______,写出该反应的化学方程式______.
[实验结论]反应后F中的固体物质含有碳酸根离子.二氧化碳与过氧化钠反应的化学方程式为______.
[拓展联系]利用虚线框内装置还可以作为实验室制备______的发生装置,写出反应的化学方程式______.
查看习题详情和答案>>

(1)关闭E打开C,从长颈漏斗A中加入液体与锥形瓶B中的固体接触,即有二氧化碳气体产生.观察到D中的蜡烛慢慢熄灭,说明二氧化碳具有______性质.写出实验室制取二氧化碳的化学方程式______.
(2)关闭C打开E,观察到G中的蜡烛燃烧得更旺,说明有氧气生成.
[查阅资料]二氧化碳能与过氧化钠(Na2O2)反应生成碳酸钠和氧气.
[实验探究]要检验反应后F中的固体物质含有碳酸钠,可取少量反应后F中的固体物质于试管中,滴入______,观察到有气泡产生;用蘸有澄清石灰水的玻璃片放在试管口,观察到______,写出该反应的化学方程式______.
[实验结论]反应后F中的固体物质含有碳酸根离子.二氧化碳与过氧化钠反应的化学方程式为______.
[拓展联系]利用虚线框内装置还可以作为实验室制备______的发生装置,写出反应的化学方程式______.
某兴趣小组利用下图装置进行二氧化碳的制取和部分性质实验,回答下列问题: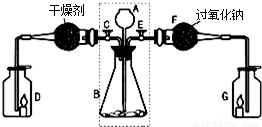
(1)关闭E打开C,从长颈漏斗A中加入液体与锥形瓶B中的固体接触,即有二氧化碳气体产生.观察到D中的蜡烛慢慢熄灭,说明二氧化碳具有______性质.写出实验室制取二氧化碳的化学方程式______.
(2)关闭C打开E,观察到G中的蜡烛燃烧得更旺,说明有氧气生成.
[查阅资料]二氧化碳能与过氧化钠(Na2O2)反应生成碳酸钠和氧气.
[实验探究]要检验反应后F中的固体物质含有碳酸钠,可取少量反应后F中的固体物质于试管中,滴入______,观察到有气泡产生;用蘸有澄清石灰水的玻璃片放在试管口,观察到______,写出该反应的化学方程式______.
[实验结论]反应后F中的固体物质含有碳酸根离子.二氧化碳与过氧化钠反应的化学方程式为______.
[拓展联系]利用虚线框内装置还可以作为实验室制备______的发生装置,写出反应的化学方程式______.
查看习题详情和答案>>

(1)关闭E打开C,从长颈漏斗A中加入液体与锥形瓶B中的固体接触,即有二氧化碳气体产生.观察到D中的蜡烛慢慢熄灭,说明二氧化碳具有______性质.写出实验室制取二氧化碳的化学方程式______.
(2)关闭C打开E,观察到G中的蜡烛燃烧得更旺,说明有氧气生成.
[查阅资料]二氧化碳能与过氧化钠(Na2O2)反应生成碳酸钠和氧气.
[实验探究]要检验反应后F中的固体物质含有碳酸钠,可取少量反应后F中的固体物质于试管中,滴入______,观察到有气泡产生;用蘸有澄清石灰水的玻璃片放在试管口,观察到______,写出该反应的化学方程式______.
[实验结论]反应后F中的固体物质含有碳酸根离子.二氧化碳与过氧化钠反应的化学方程式为______.
[拓展联系]利用虚线框内装置还可以作为实验室制备______的发生装置,写出反应的化学方程式______.
查看习题详情和答案>>
运用化学反应原理研究碳的氧化物的性质具有重要意义.
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高.下列措施不能够有效控制CO2所导致的温室效应的是
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出84消毒液露置在空气中发生反应的离子方程式
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应.
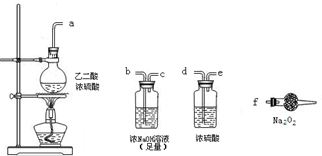
已知:H2C2O4
CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为
(4)已知C(s)+O2(g)=CO2(g),△H=-393.5kJ?mol-1;CO(g)+
O2(g)=CO2(g),△H=-283.0kJ?mol-1,写出CO2 和C(s)反应的热化学方程式
查看习题详情和答案>>
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高.下列措施不能够有效控制CO2所导致的温室效应的是
④
④
(填序号)①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出84消毒液露置在空气中发生反应的离子方程式
ClO-+CO2+H2O=HClO+HCO3-;2HClO=2H++2Cl-+O2↑
ClO-+CO2+H2O=HClO+HCO3-;2HClO=2H++2Cl-+O2↑
.(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应.

已知:H2C2O4
| ||
| △ |
abcf
abcf
;若CO能够与Na2O2发生反应,则预测反应产物为Na2CO3
Na2CO3
.(4)已知C(s)+O2(g)=CO2(g),△H=-393.5kJ?mol-1;CO(g)+
| 1 |
| 2 |
CO2(g)+C(s)=2CO(g)△H=+172.5kJ?mol-1
CO2(g)+C(s)=2CO(g)△H=+172.5kJ?mol-1
.以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为CO+CO32-→2CO2+2e-
CO+CO32-→2CO2+2e-
.若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)11.2
11.2
L.