网址:http://m.1010jiajiao.com/timu3_id_185207[举报]
(10分)实验室制取并收集氯气的装置如右图:某同学进行实验时可能有如下操作:
(1)烧瓶中发生反应的化学方程式是:___________________________。
(2)制得的氯气可选用_______________来干燥,烧杯中发生反应的离子方程式是_________________。
(3)在实验室里,常用加热食盐晶体和浓硫酸的混合物的方法来制取HCl,HCl是一种
无色有刺激性气味的气体,密度比空气大,极易溶于水,它的水溶液叫氢氯酸,即盐酸。
①实验室制取HCl的发生装置可选用制__ ___的发生装置(填O2、Cl2、CO2中的一种)。
②收集氯化氢气体时应采用__________法。
③实验室可用__________________________试纸放在瓶口检验HCl是否充满了集气瓶。
④上图哪些装置可作为多余氯化氢的吸收装置?______________________________。
查看习题详情和答案>>
(10分)实验室制取并收集氯气的装置如右图:某同学进行实验时可能有如下操作:
(1)烧瓶中发生反应的化学方程式是:___________________________。
(2)制得的氯气可选用____________来干燥,烧杯中发生反应的离子方程式是_________________。
(3)在实验室里,常用加热食盐晶体和浓硫酸的混合物的方法来制取HCl,HCl是一种无色有刺激性气味的气体,密度比空气大,极易溶于水,它的水溶液叫氢氯酸,即盐酸。
①实验室制取HCl的发生装置可选用制__ ___的发生装置(填O2、Cl2、CO2中的一种)。
②收集氯化氢气体时应采用__________法。
③实验室可用__________________________试纸放在瓶口检验HCl是否充满了集气瓶。
④上图哪些装置可作为多余氯化氢的吸收装置?______________________________。
(10分)实验室制取并收集氯气的装置如右图:某同学进行实验时可能有如下操作:

(1)烧瓶中发生反应的化学方程式是:___________________________。
(2)制得的氯气可选用_______________来干燥,烧杯中发生反应的离子方程式是_________________。
(3)在实验室里,常用加热食盐晶体和浓硫酸的混合物的方法来制取HCl,HCl是一种
无色有刺激性气味的气体,密度比空气大,极易溶于水,它的水溶液叫氢氯酸,即盐酸。
①实验室制取HCl的发生装置可选用制__ ___的发生装置(填O2、Cl2、CO2中的一种)。
②收集氯化氢气体时应采用__________法。

③实验室可用__________________________试纸放在瓶口检验HCl是否充满了集气瓶。
④上图哪些装置可作为多余氯化氢的吸收装置?______________________________。
查看习题详情和答案>>
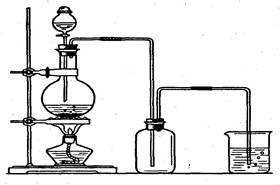
(1)烧瓶中发生反应的化学方程式是:___________________________。
(2)制得的氯气可选用____________来干燥,烧杯中发生反应的离子方程式是_________________。
(3)在实验室里,常用加热食盐晶体和浓硫酸的混合物的方法来制取HCl,HCl是一种无色有刺激性气味的气体,密度比空气大,极易溶于水,它的水溶液叫氢氯酸,即盐酸。
①实验室制取HCl的发生装置可选用制__ ___的发生装置(填O2、Cl2、CO2中的一种)。
②收集氯化氢气体时应采用__________法。
③实验室可用__________________________试纸放在瓶口检验HCl是否充满了集气瓶。
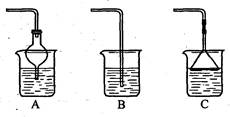
④上图哪些装置可作为多余氯化氢的吸收装置?______________________________。

(1)收集导管B处的气体可采用的方法是
(2)烧杯内放过量稀HNO3的原因是
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是
(4)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3?6H2O,而不用直接蒸干的方法来制得晶体的理由是
(5)你认为该实验存在的缺点可能有: