摘要:24. 某化学课外活动小组计划用NaOH溶液制取简易消毒液.反应原理为: 写出氯气与NaOH溶液反应的离子方程式). (1)实验室有已配好的NaOH溶液.一瓶是所贴标签是4.0 mol·L-1.另一瓶所贴标签为14%(密度为114 g·mL-1正以).则14%的NaOH溶液的物质的量浓度为 .. (2)若要使1.12 L氯气(STP)与4.0mol·L-1.NaOH溶液恰好完全反应.所需NaOH溶液的体积为 . (3)配制250mL 4.0 mol·L-1NaOH溶液的实验步骤: a.计算需要氢氧化钠固体的质量. b.称量氢氧化钠固体. c.将烧杯中的溶液注入容量瓶.并用少量蒸馏水洗涤烧杯内壁2~3次.洗涤液也注入容量瓶. d.用适量的蒸馏水溶解称量好的氢氧化钠固体.冷却. e.继续向容量瓶中加蒸馏水至刻度线下1~2cm时.改用胶头滴管滴加蒸馏水至凹液面与刻度线相切. f.盖好瓶塞.反复上下颠倒.摇匀. ①d步骤中所用到的仪器有 . ②c步骤中所用的容量瓶壁上.标出的物理量及其数值为 . ③上述步骤的正确操作顺序是 . (4)玻璃棒是化学实验中常用的仪器.下列有关实验过程中.肯定需要使用玻璃棒进行操作的是 . a.一定溶质质量分数溶液的配制. b.用普通漏斗组成的过滤装置进行过滤实验. c.将适量的氯化铁饱和溶液滴入沸水制氢氧化铁胶体.
网址:http://m.1010jiajiao.com/timu3_id_184594[举报]
 (2012?宜春模拟)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同.气体成分可能含SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式.实验用到的仪器如图所示:
(2012?宜春模拟)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同.气体成分可能含SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式.实验用到的仪器如图所示:[提出假设]
Ⅰ.所得气体的成分可能只含
SO3
SO3
一种;Ⅱ.所得气体的成分可能含有
SO2、O2
SO2、O2
二种;Ⅲ.所得气体的成分可能含有SO2、SO3、O2三种.
[实验探究]实验操作过程(略).已知实验结束时,硫酸铜完全分解.
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为
①③④⑧⑦②
①③④⑧⑦②
(填序号、仪器不重复使用).(2)实验过程中,仪器C的作用是
吸收SO2、SO3气体
吸收SO2、SO3气体
.[验证假设,分析推理]
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同.数据如下:
| 实验 小组 |
称取CuSO4 的质量/g |
仪器C增 加的质量/g |
量筒中水的体积折算标 准状况下气体的体积/mL |
| ① | 6.4 | 2.56 | 224 |
| ② | 6.4 | 2.56 | 448 |
2CuSO4
2CuO+2SO2↑+O2↑
| ||
2CuSO4
2CuO+2SO2↑+O2↑
;若将①小组CuSO4分解时所得气体在一定条件下反应,恢复到反应前的温度和压强时,测得密度是反应前的
| ||
| 10 |
| 9 |
64.0
64.0
(保留一位小数);指导老师认为利用上述装置测得的仪器C增重量偏小,他的理由可能是C装置前的装置内残余了部分SO2气体.
C装置前的装置内残余了部分SO2气体.
.某化学课外活动小组甲同学欲制备收集A气体,乙同学欲制备收集B气体(制备方法、装置、试剂的化学式均相同).甲采用排水法收集到B气体,乙用排空气法却得到A气体.下列关于A、B两种气体的叙述不正确的是( )
查看习题详情和答案>>
(2010?揭阳一模)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同.气体成分可能含SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组通过设计一探究性实验,探索测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式.实验可能用到的仪器如图所示:

[提出猜想]
Ⅰ.所得气体的成分可能只含
Ⅱ.所得气体的成分可能含有
Ⅲ.所得气体的成分可能含有
[实验探究]
实验操作过程(略).已知实验结束时,硫酸铜完全分解.请回答下列问题:
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
(2)若实验结束,B中量筒没有收集到水,则证明猜想
(3)若实验结束,经测定装置C的总质量增加了,能否肯定气体产物中含有SO2而不含SO3?
请说明理由.答:
(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后,测得相关数据也不同,数据如下:
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学反应方程式:
一组:
二组:
(5)该实验设计中,由于实验操作的原因容易给测定带来最大误差的两个仪器是
查看习题详情和答案>>

[提出猜想]
Ⅰ.所得气体的成分可能只含
SO3
SO3
一种;Ⅱ.所得气体的成分可能含有
SO2、O2
SO2、O2
二种;Ⅲ.所得气体的成分可能含有
SO3、SO2、O2
SO3、SO2、O2
三种.[实验探究]
实验操作过程(略).已知实验结束时,硫酸铜完全分解.请回答下列问题:
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
①⑨⑩⑥⑤③④⑧⑦②
①⑨⑩⑥⑤③④⑧⑦②
(填序号)(2)若实验结束,B中量筒没有收集到水,则证明猜想
Ⅰ
Ⅰ
正确.(3)若实验结束,经测定装置C的总质量增加了,能否肯定气体产物中含有SO2而不含SO3?
请说明理由.答:
不能,因为SO3与F中的饱和NaHSO3反应会生成等物质的量的SO2
不能,因为SO3与F中的饱和NaHSO3反应会生成等物质的量的SO2
.(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后,测得相关数据也不同,数据如下:
| 实验小组 | 称取CuSO4 的质量(g) |
装置C增加 的质量(g) |
量筒中水的体积折算成标 准状况下气体的体积(mL) |
| 一 | 6.4 | 2.56 | 298.7 |
| 二 | 6.4 | 2.56 | 448 |
一组:
3CuSO4
3CuO+2SO2↑+SO3↑+O2↑
| ||
3CuSO4
3CuO+2SO2↑+SO3↑+O2↑
;
| ||
二组:
2CuSO4
2CuO+2SO2↑+O2↑
| ||
2CuSO4
2CuO+2SO2↑+O2↑
.
| ||
(5)该实验设计中,由于实验操作的原因容易给测定带来最大误差的两个仪器是
B
B
和E
E
(填代号).(2013?聊城一模)某化学课外活动小组通过实验研究NO2的性质.
已知:2NO2+2NaOH═NaNO3+NaNO2+H2O
利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去).
(1)E装置中制取NO2反应的离子方程式是
(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取
a.NH4HCO3 b.NH4Cl c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是
(4)实验过程中,未能观察到C装置中的预期现象.该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③
(5)此实验装置存在一个明显的缺陷是
(6)探究NO2能否与Na2O2发生氧化还原反应.为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图2所示),重新组装,进行实验.
装置的合理连接顺序是
查看习题详情和答案>>
已知:2NO2+2NaOH═NaNO3+NaNO2+H2O
利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去).

(1)E装置中制取NO2反应的离子方程式是
Cu+4H++2NO3-═Cu2++2NO2↑+2H2O
Cu+4H++2NO3-═Cu2++2NO2↑+2H2O
.(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取
a
a
a.NH4HCO3 b.NH4Cl c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是
C装置中混合气体颜色变浅
C装置中混合气体颜色变浅
.(4)实验过程中,未能观察到C装置中的预期现象.该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③
在此条件下,该反应的化学反应速率极慢
在此条件下,该反应的化学反应速率极慢
.(5)此实验装置存在一个明显的缺陷是
缺少尾气吸收装置
缺少尾气吸收装置
.(6)探究NO2能否与Na2O2发生氧化还原反应.为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图2所示),重新组装,进行实验.
装置的合理连接顺序是
EDBDF或EDBF或FDBDE或FBDE
EDBDF或EDBF或FDBDE或FBDE
.实验过程中,B装置中淡黄色粉末逐 渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为2NO2+Na2O2═2NaNO3
2NO2+Na2O2═2NaNO3
.(2012?海淀区一模)某化学课外活动小组通过实验研究NO2的性质.
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O
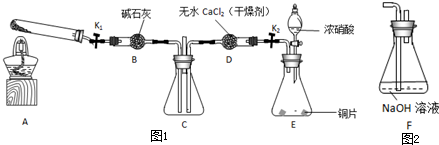
任务1:利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去).
(1)E装置中制取NO2反应的化学方程式是
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是
(3)实验过程中,未能观察到C装置中的预期现象.该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③
(4)此实验装置存在一个明显的缺陷是
任务2:探究NO2能否与Na2O2发生氧化还原反应.
(5)实验前,该小组同学提出三种假设.
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图2所示),重新组装,进行实验.
①装置的合理连接顺序是(某些装置可以重复使用)
②实验过程中,B装置中淡黄色粉末逐渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为
查看习题详情和答案>>
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O

任务1:利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去).
(1)E装置中制取NO2反应的化学方程式是
Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
.(2)若NO2能够被NH3还原,预期观察到C装置中的现象是
C装置中混合气体颜色变浅
C装置中混合气体颜色变浅
.(3)实验过程中,未能观察到C装置中的预期现象.该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③
在此条件下,该反应的化学反应速率极慢
在此条件下,该反应的化学反应速率极慢
.(4)此实验装置存在一个明显的缺陷是
缺少尾气吸收装置
缺少尾气吸收装置
.任务2:探究NO2能否与Na2O2发生氧化还原反应.
(5)实验前,该小组同学提出三种假设.
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:
NO2能被Na2O2还原
NO2能被Na2O2还原
.(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图2所示),重新组装,进行实验.
①装置的合理连接顺序是(某些装置可以重复使用)
EDBDF或EDBF
EDBDF或EDBF
.②实验过程中,B装置中淡黄色粉末逐渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为
2NO2+Na2O2═2NaNO3
2NO2+Na2O2═2NaNO3
.