摘要:一般书写离子方程式时可分四步: ①写--根据客观事实.写出正确的 . ②拆--把易溶于水且易电离的物质写成 形式.把难溶于水的物质或难电离的物质以及气体.单质.氧化物仍用 表示.对于难溶于水但易溶于酸的物质.如CaCO3.FeS.Cu(OH)2.Mg(OH)2等仍应写成化学式. ③删--对方程式两边都有的相同离子.把其中不参加反应的离子.应“按数 消掉. ④查--检查写出的离子方程式是否符合前三项规定.并检查是否既符合质量守恒又符合电荷守恒.即方程式两边各元素的原子个数是否 .方程式两边各离子所带电荷总数是否 .
网址:http://m.1010jiajiao.com/timu3_id_183934[举报]
氰(CN)2、硫氰(SCN)2等称为拟卤素,它们与卤素单质性质相似,它们的阴离子也与卤素阴离子性质相似。例如:
2Fe+3(SCN)2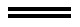 2Fe(SCN)3
2Fe(SCN)3
Ag++CN-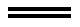 AgCN↓(白)
AgCN↓(白)
拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱。下列反应中,不正确的是( C )
A. 2CN-+Cl2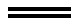 2Cl-+(CN)2
2Cl-+(CN)2
B. (CN)2+2OH-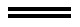 CN-+CNO-+H2O
CN-+CNO-+H2O
C. (CN)2+H2O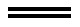 2H++CN-+CNO-
2H++CN-+CNO-
B. MnO2+4HSCN (SCN)2+Mn(SCN)2+2H2O
(SCN)2+Mn(SCN)2+2H2O
【解析】 从题中信息可以看出,拟卤素形成的无氧酸和含氧酸均为弱酸,书写离子方程式时不能拆开成离子。
查看习题详情和答案>>下列说法正确的是( )
| A、强电解质溶液一定比弱电解质溶液的导电性强 | B、强电解质的稀溶液中不存在溶质分子 | C、强电解质都是离子化合物,而弱电解质都是共价化合物 | D、强电解质在书写离子方程式时都应写成离子形式 |