摘要:18.在反应a BrF3 + b H2O = c HBrO3 + d Br2 + e HF + f O2 中(a. b .c. d. e. f是各物质的化学计量数),若0.3mol H2O被氧化,则被水还原的 BrF3 的物质的量是 A.0.3mol B. 0.2mol C.0.4mol D. 0.5mol
网址:http://m.1010jiajiao.com/timu3_id_183349[举报]
在反应a BrF3+bH2O=c HBrO3+d HBr+e HF+f O2中(a,b,c,d,e,f是各物质的化学计量数),若0.3mol H2O被氧化,则被水还原的BrF3的物质的量是
- A.0.15mol
- B.0.2mol
- C.0.3mol
- D.0.4mol
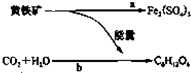 1951年,有人从煤矿的坑水中分离出了一种氧化铁硫杆菌.它能促使黄铁矿(FeS2)氧化成硫酸铁和硫酸.后来又发现了能把矿物中的硫或硫化物氧化成硫酸的氧化硫杆菌.而硫酸和硫酸铁能将某些矿石中的金属元素转化成相应金属的硫酸盐.从而开辟了“细菌冶金”的先河.氧化铁硫杆菌的活动过程如图,其中a过程发生的反应为:
1951年,有人从煤矿的坑水中分离出了一种氧化铁硫杆菌.它能促使黄铁矿(FeS2)氧化成硫酸铁和硫酸.后来又发现了能把矿物中的硫或硫化物氧化成硫酸的氧化硫杆菌.而硫酸和硫酸铁能将某些矿石中的金属元素转化成相应金属的硫酸盐.从而开辟了“细菌冶金”的先河.氧化铁硫杆菌的活动过程如图,其中a过程发生的反应为:4FeS2+15O2+2H2O
| ||
| A、a过程是释放能量的过程 |
| B、b过程类似于植物的光合作用,细菌将能量储存在C6H1206中 |
| C、细菌在反应a过程中起了催化剂的作用 |
| D、有些细菌可以直接把含重金属的矿石溶解,得到含重金属离子的溶液 |
下列说法中正确的是( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.在反应A(g)+3B(g)=2C(g)+2D(g)的速率测定实验中,分别测得反应速率如下:v(A)= 0.15mol·L-1·s-1,
v (C)=0.3 mol·L-1·s-1,则用C来表示反应进行的速率更快。
C.如图所示,在一U型管中装入含有紫色石蕊试液的Na2SO4溶液,通直流电,一段时间后U型管内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是:红、紫、蓝

D.反应HCl(aq) + NaOH(aq) = NaCl (aq) + H2O(l) △H < 0, 在理论上能用于设计原电池。
查看习题详情和答案>>
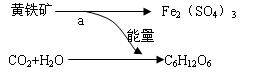
1951年有人从煤矿的坑水中分离出了一种氧化铁硫杆菌。它能促使促使黄铁矿(FeS2)氧化成硫酸铁和硫酸。后来又发现了能把矿物中的硫或硫化物氧化成硫酸的氧化硫杆菌。而硫酸和硫酸铁能将某些矿石中金属元素转化成相应金属的的硫酸盐。从而开辟了“细菌冶金”的先河。氧化铁硫杆菌的活动过程如图:其中a过程发生的反应为:4FeS2+15O2+2H2O![]() 2Fe2(SO4)3+2H2SO4。
2Fe2(SO4)3+2H2SO4。
则下列说法不正确的是
A、a过程是释放能量的过程
B、b过程类似于植物的光合作用,细菌将能量储存在C6H12O6中
C、细菌在反应a过程中起了催化剂的作用
D、有些细菌可以直接把含重金属的矿石溶解,得到含重金属离子的溶液
查看习题详情和答案>>