网址:http://m.1010jiajiao.com/timu3_id_182096[举报]
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
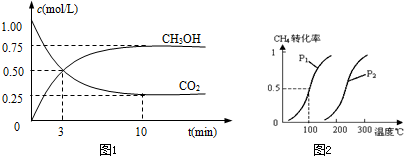
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施中能使n(CH3OH)/n(CO2)增大的是
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3molH2.
Ⅱ.工业上也可以通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1;②CO(g)+2H2(g)?CH3OH(g)△H2
将0.20mol CH4和0.30molH2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图2.
(1)温度不变,缩小体积,增大压强,①的反应速率
(2)反应①的△H1
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
A.29% B.43% C.50% D.100%
查看习题详情和答案>>A.29% B.43%
C.50% D.100%
查看习题详情和答案>>氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法。用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO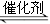 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
|
时间(s) |
0 |
2 |
4 |
|
c(NO) ( mol·L-1) |
1.00×10-3 |
2.50×10-4 |
1.00×10-4 |
|
c(CO) ( mol·L-1) |
3.60×10-3 |
c’ |
2.70×10-3 |
回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前4s内的平均反应速率v(NO)= 。c’= 。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。右图表示在其他条件不变时,上述反应中二氧化碳浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。

①该反应的ΔH 0(填“>”、“<”或“=”)。
②若催化剂的表面积S1>S2,在答题卡图中画出c(CO2) 在T2、S2条件下达到平衡过程中的变化曲线。
(3)在恒容的密闭容器中,上述反应达到平衡后,改变某一条件,下列示意图正确的是

A. B. C. D.
查看习题详情和答案>>