摘要:50.已知碳酸氢钠不稳定.受热易分解(2NaHCO3 加热 Na2CO3 + H2O+CO2↑).现取Na2CO3和NaHCO3的混合物40g.加热到质量不再改变为止.剩余固体质量为27.6g.下列说法正确的是( ) A.反应后生成CO2的质量为12.4g B.反应后CO2和H2O的质量比为22∶9 C.原混合物中NaHCO3的质量为16.8g D.原混合物中Na2CO3的质量分数为16% II卷 班级 学号 得分 总分
网址:http://m.1010jiajiao.com/timu3_id_181838[举报]
下面有关碳酸钠和碳酸氢钠说法不正确的是( )
| A、碳酸氢钠不稳定,受热易分解 | B、碳酸氢钠可以用作治疗胃酸过多的药物 | C、碳酸钠溶液显碱性,所以碳酸钠是碱 | D、碳酸钠既是钠盐、又是碳酸盐、还是可溶性盐 |
下面有关碳酸钠和碳酸氢钠说法不正确的是
A、碳酸氢钠不稳定,受热易分解
B、碳酸氢钠可以用作治疗胃酸过多的药物
C、碳酸钠溶液显碱性,所以碳酸钠是碱
D、碳酸钠既是钠盐、又是碳酸盐、还是可溶性盐
查看习题详情和答案>>
下面有关碳酸钠和碳酸氢钠说法不正确的是
- A.碳酸氢钠不稳定,受热易分解
- B.碳酸氢钠可以用作治疗胃酸过多的药物
- C.碳酸钠溶液显碱性,所以碳酸钠是碱
- D.碳酸钠既是钠盐、又是碳酸盐、还是可溶性盐
已知碳酸氢钠在270℃左右就能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解.现有某工厂生产出的一批碳酸氢钠中混有少量的碳酸钠,为了测定产品中碳酸氢钠的质量分数,具体的检验步骤如下:
①取一只洁净的坩埚,称其质量为a g;再向其中加入样品.称得总质量为m1 g;
②加热该盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为m2 g.
(1)写出碳酸氢钠受热分解的化学方程式 .
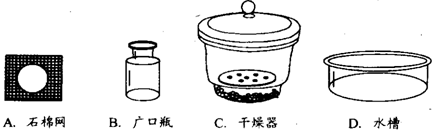
(2)用 (填仪器名称)将加热后的坩埚放到 中(填序号)冷却.
(3)根据题意,用a、m1、m2的代数式表示样品中碳酸氢钠的质量分数为 .
(4)步骤①、③和④都需要用到精度为0.1g的托盘天平称量,若本题中(m1-m2)的值超过0.6g,假设样品中碳酸氢钠的质量分数为90%,则至少需称样品多少克?
查看习题详情和答案>>
①取一只洁净的坩埚,称其质量为a g;再向其中加入样品.称得总质量为m1 g;
②加热该盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为m2 g.
(1)写出碳酸氢钠受热分解的化学方程式
(2)用
(3)根据题意,用a、m1、m2的代数式表示样品中碳酸氢钠的质量分数为
(4)步骤①、③和④都需要用到精度为0.1g的托盘天平称量,若本题中(m1-m2)的值超过0.6g,假设样品中碳酸氢钠的质量分数为90%,则至少需称样品多少克?

已知碳酸氢钠在270℃左右就能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解.现有某工厂生产出的一批碳酸氢钠中混有少量的碳酸钠,为了测定产品中碳酸氢钠的质量分数,具体的检验步骤如下:
①取一只洁净的坩埚,称其质量为a g;再向其中加入样品.称得总质量为m1 g;
②加热该盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为m2 g.
(1)写出碳酸氢钠受热分解的化学方程式________.
(2)用________(填仪器名称)将加热后的坩埚放到________中(填序号)冷却.
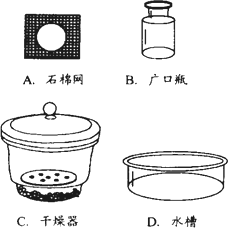
(3)根据题意,用a、m1、m2的代数式表示样品中碳酸氢钠的质量分数为________.
(4)步骤①、③和④都需要用到精度为0
.1 g的托盘天平称量,若本题中(m1-m2)的值超过0.6 g,假设样品中碳酸氢钠的质量分数为90%,则至少需称样品多少克?