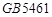网址:http://m.1010jiajiao.com/timu3_id_180754[举报]
(8分)市场销售的某种食用精制盐包装袋上有如下说明(部分):
| 产品标准 |
|
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处): ![]() +
+ ![]() +
+ ![]() 4 =
4 = ![]() +
+ ![]() +
+ ![]()
(2)上述反应生成的![]() 可用四氯化碳检验。向碘的四氯化碳溶液中加入
可用四氯化碳检验。向碘的四氯化碳溶液中加入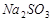 稀溶液,将
稀溶液,将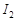 还原,以回收四氯化碳。
还原,以回收四氯化碳。
①![]() 稀溶液与
稀溶液与![]() 反应的离子方程式是
反应的离子方程式是
②某学生设计回收四氯化碳的操作步骤为:
a、将碘的四氯化碳溶液置于分液漏斗中; b、加入适量![]() 稀溶液;
稀溶液;
c、分离出下层液体。
以上设计中遗漏的操作及在上述操作中的位置是
(3)已知:![]()
某学生测定食用精制盐的碘含量,其步骤为:
a、准确称取![]() 食盐,加适量蒸馏水使其完全溶解;
食盐,加适量蒸馏水使其完全溶解;
b、用稀硫酸酸化所得溶液,加入足量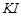 溶液,使食用盐中
溶液,使食用盐中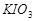 与
与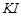 反应完全;
反应完全;
c、以淀粉溶液为指示剂,逐滴加入物质的量浓度为![]() 的
的![]() 溶液
溶液![]() ,恰好反应完全。
,恰好反应完全。
①判断c中反应恰好完全依据的现象是
②根据以上实验和包装说明,所测精盐的碘含量是 ![]()
查看习题详情和答案>>
(8分)市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配 料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于方框内)
□ KIO3 + □KI + □H2SO4 = □K2SO4 + □I2 + □H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
已知Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式: 。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是:________________________________;
②b中反应所产生的I2的物质的量是: mol;
查看习题详情和答案>>
(8分)市场销售的某种食用精制盐包装袋上有如下说明(部分):
|
产品标准 |
|
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处): 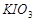 +
+ 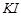 +
+
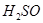 4
=
4
=  +
+
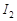 +
+

(2)上述反应生成的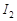 可用四氯化碳检验。向碘的四氯化碳溶液中加入
可用四氯化碳检验。向碘的四氯化碳溶液中加入 稀溶液,将
稀溶液,将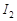 还原,以回收四氯化碳。
还原,以回收四氯化碳。
① 稀溶液与
稀溶液与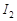 反应的离子方程式是
反应的离子方程式是
②某学生设计回收四氯化碳的操作步骤为:
a、将碘的四氯化碳溶液置于分液漏斗中; b、加入适量 稀溶液;
稀溶液;
c、分离出下层液体。
以上设计中遗漏的操作及在上述操作中的位置是
(3)已知: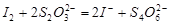
某学生测定食用精制盐的碘含量,其步骤为:
a、准确称取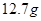 食盐,加适量蒸馏水使其完全溶解;
食盐,加适量蒸馏水使其完全溶解;
b、用稀硫酸酸化所得溶液,加入足量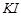 溶液,使食用盐中
溶液,使食用盐中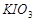 与
与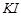 反应完全;
反应完全;
c、以淀粉溶液为指示剂,逐滴加入物质的量浓度为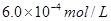 的
的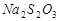 溶液
溶液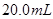 ,恰好反应完全。
,恰好反应完全。
①判断c中反应恰好完全依据的现象是
②根据以上实验和包装说明,所测精盐的碘含量是
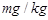
查看习题详情和答案>>
市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50 mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是 ;所缺步骤为 。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为6.0×10-4mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②根据以上实验和包装袋说明,所测精制盐的碘含量是 mg/kg
查看习题详情和答案>>市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 | .w.^w.k.&s.5*u.c.#om. |
(1)碘酸钾与碘化钾在酸性条件下![]() 发生如下反应,
发生如下反应,
KIO![]() +5KI+3H2SO4 = 3K2SO4+ 3
+5KI+3H2SO4 = 3K2SO4+ 3![]() + 3H2O
+ 3H2O
上述反应生成的![]() 可用四氯化碳检验:确认有
可用四氯化碳检验:确认有![]() 生成的现象是___________________
生成的现象是___________________
利用![]() 稀溶液,将
稀溶液,将![]() 还原,可从碘的四氯化碳溶液中回收四氯化碳。
还原,可从碘的四氯化碳溶液中回收四氯化碳。![]() 稀溶液与
稀溶液与![]() 反应的离子方程式为 。
反应的离子方程式为 。
(2)已知:![]() 某学生测定食用精制盐的碘含量,其步骤为:
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解:
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO![]() 与KI反应完全;
与KI反应完全;
c.以淀粉溶液为指示剂。逐滴加入物质的量浓度为2.0×10![]() mol/L的
mol/L的![]() 溶液10.0mL,恰好反应完全。
溶液10.0mL,恰好反应完全。![]()
①判断c中恰好完全反应依据的现象是_____________________________________。
②b中反应所产生的![]() 的物质的量是多少?(写出计算过程)
的物质的量是多少?(写出计算过程)
③根据以上实验和包装袋说明测得精制盐的碘(I)含量(以含w的代数式表示,单位为mg/kg)。(写出计算过程)
查看习题详情和答案>>