网址:http://m.1010jiajiao.com/timu3_id_180728[举报]
(1)良好的生态环境可以提升生活质量.
①近两年来,全国多个省市出现严重的雾霾天气.导致雾霾形成的主要污染物是
a.SO2 b.NO2 c.CO2 d.PM2.5
②以下物质垃圾不属于“
 ”标志的是
”标志的是a.废报纸 b.废铝制的易拉罐 c.烟蒂、渣土
③综合利用“地沟油”的一种方法是将它水解以获取高级脂肪酸和
(2)人体健康与食品、药物等关系密切.
①生活中应合理地摄取人体必需的元素,体内
a.感冒发烧 b.细菌感染 c.胃酸过多
②小苏打可用来治疗胃酸过多,请写出该反应的离子方程式:
③维生素C是生命活动的重要物质.在氯化铁溶液中加入维生素C后,溶液由黄色转变为浅绿色,说明维生素C具有较强的
④糖类、油脂、蛋白质都是人体必需的营养物质.其中蛋白质被摄入人体后,在酶的作用下水解为
(3)材料是人类赖以生存和发展的重要物质基础.
①在下列材料中,属于无机非金属材料的是
a.硬币 b.聚氯乙烯塑料 c.氮化硅陶瓷
②硅酸盐水泥是常用的建筑材料,它主要是以
③晶体硅是半导体材料,二氧化硅是光纤的主要成分,晶体硅和二氧化硅都属于
④橡胶是制造轮胎的重要原料,天然橡胶通过硫化处理,使它的分子转化为
⑤钢铁的生产与使用是人类文明和生活进步的一个重要标志.工业炼铁原理的主要化学反应方程式为
钢铁的腐蚀主要是由
(1)(3分)人体健康与食品等关系密切。
①生活中应合理地摄取人体必需的元素,体内_______ _ 含量过高,会引起甲状腺疾病[
②。糖类、油脂、蛋白质都是人体必需的营养物质。其中蛋白质被摄入人体后,在酶的作用下最终水解为_______________________(写名称)。
③棉花纤维的化学成分是 (写化学式)。
(2)(5分)中国是世界上最早研究和生产合金的国家之一。
①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点 。
②黄铜(铜锌合金)外观和金(Au)相似,常被误认为黄金。
试写出一种鉴别黄铜与黄金的化学方法 。铜器表面容易生成一层薄薄的铜绿[主要成份是Cu2(OH)2CO3], 请写出铜在潮湿的空气发生电化学腐蚀时的负极反应式 ;用盐酸可以除去铜器表面的铜绿,该反应的化
 学方程式为 。
学方程式为 。③下列对金属制品采取的防护方法不正确的是 (填序号)。
A.在电线的外面包上一层塑料层
B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
(3)(7分)生活处处有化学,化学与生产、生活密切相关。
①小孩误服重金属盐后,应立即 ,以减少人体蛋白质中毒的程度。
②食品添加剂亚硝酸钠的外观像食盐,并有咸味,但亚硝酸钠有很强的毒性。亚硝酸钠属于 (选填“调味剂”、“防腐剂”或“着色剂”)。
③维生素C的结构为



 它是一种水溶性的维生素,缺乏VC会使人患上 病。切取一片新鲜水果,向切面上滴加淀粉溶液和碘水,若出现 ,说明新鲜水果中含有VC,这是利用VC具有 (填
它是一种水溶性的维生素,缺乏VC会使人患上 病。切取一片新鲜水果,向切面上滴加淀粉溶液和碘水,若出现 ,说明新鲜水果中含有VC,这是利用VC具有 (填 “氧化”或“还原”)性质。
“氧化”或“还原”)性质。④乙酰水杨酸(
 )的俗名为阿司匹林,是常用药。它遇水能缓慢地水解生成水杨酸,则水杨酸的结构简式可表示为
)的俗名为阿司匹林,是常用药。它遇水能缓慢地水解生成水杨酸,则水杨酸的结构简式可表示为  。
。《化学与生活》
(1)材料是人类赖以生存和发展的重要物质基础.
①生产水泥的主要原料是黏土和________(填名称).
②有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料,而是一种________.(选填“橡胶”或“纤维”或“塑料”)
③上海世博会中国馆用到一种涂料-氟碳涂层聚酯(FEP),它的单体为CF3-CF=CF2,这种涂料具有________(选填“热塑性”或“热固性”).
④玻璃钢具有耐腐蚀、质量轻、强度高的性能,它属于________材料(选填“合金”或“复合”).
(2)人体健康与食品、药物等关系密切.
①有些学生从小偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,这主要是由于摄取________(选填“脂肪”、“维生素”或“蛋白质”)不足引起的.
②生活中应合理地摄取人体必需的元素,体内________含量过高,会引起甲状腺疾病.
③糖类、油脂、蛋白质都是人体必需的营养物质.其中蛋白质被摄入人体后,在酶的作用下水解为________(写名称).
④小苏打可用来治疗胃酸过多,请写出该反应的离子方程式________.
⑤可以帮助流感病人解热镇痛的药物是________(选填“青霉素”或“阿司匹林”).
(3)洁净安全的生存环境更是健康的保障.
①为确保上海世博会期间城市空气质量优良率达到95%以上,世博会期间的空气质量状况监测中,不需要监测的指标是________.
a.可吸入颗粒物(PM10)
b.NO2浓度
c.SO2浓度
d.CO2浓度
②可利用漂白粉对河水进行杀菌消毒,其能杀菌消毒的原因是漂白粉会与河水反应生成HClO(用化学反应方程式表示)是________.
③垃圾的无害化处理常用的方法包括卫生填埋和________焚烧.
④人们为追求时尚而把头发染成各种各样的颜色,常见的染发剂有植物染发剂、无机染发剂和________染发剂(选填“有机”“合成”或“复合”).
铁是与日常生活密切相关的元素。
(1)在生铁中含有一种铁、碳化合物X。已知X中铁、碳的元素质量比为14∶1。X的最简式为__________。
(2)X有下列转化关系:(无关物质已经略去)

溶液甲中含有的大量阳离子是________________;溶液甲中加入H2O2发生反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(3)X与过量浓硝酸反应生成气体Z和气体W,Z是一种无色无味能使澄清石灰水变浑浊的气体,气体Z和W分别是:Z__________、W__________。
(4)Fe(OH)3胶体外观与Fe(SCN)3溶液相似,请设计一种简单的方法将它们鉴别出来且不破坏它们:________________________。
(5)某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜。活动过程如下:

①写出废铁屑与盐酸反应的离子方程式:
________________________________________________________________________。
②学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
|
实验内容 |
实验操作 |
预期现象和结论 |
|
检验黄色溶液A中是否含有Fe2+ |
|
|
|
检验绿色溶液C中是否含有Fe3+ |
|
|
查看习题详情和答案>>
ⅠNO分子因污染空气而臭名昭著.近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”.请回答下列问题.
(1)NO的危害在于
A.破坏臭氧层 B.高温下能使一些金属氧化
C.造成酸雨 D.与人体血红蛋白结合
(2)在含Cu+离子的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子(NO2-)在酸性水溶液中反应的离子方程式:
(3)已知NH3和Cl2会发生氧化还原反应,生成N2和NH4Cl.现用如图1所示的装置进行实验,打开分液漏斗的活塞,滴下浓氨水,至不再反应为止;关闭分液漏斗的活塞,待恢复到室温,打开止水夹,试管内液面上升至三分之二处.
①写出实验室制取氨气的化学方程式
②试管内发生反应的化学方程式是
③试管中发生的反应表明氨气具有
a、氧化性 b、还原性 c、碱性 d、热不稳定性
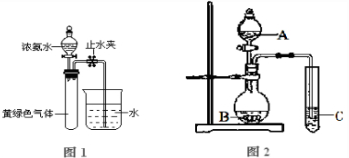
Ⅱ(1)将SO2通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,知其中含Cl:35.7%,Cu:64.3%,则SO2在上述反应中的作用是
a.漂白剂 b.氧化剂 c.还原剂
(2)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用H2O2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式
(3)用上图2实验装置可以证明硫、碳、硅三种元素的非金属性强弱.则A、B、C所代表的物质的名称:A