摘要:6.干燥仪器 仪器图形与名称 主要用途 使用方法及注意事项 内装固体干燥剂或吸收剂.用于干燥或吸收某些气体 要注意防止干燥剂液化和是否失效.气流方向大口进小口出. 洗气瓶 除去气体中的杂质 注意气流方向应该长管进气.短管出气
网址:http://m.1010jiajiao.com/timu3_id_17933[举报]
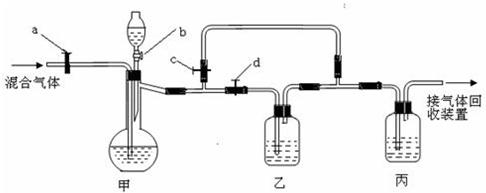
39、用下面的装置将一定量的CO2和CO的混合气体进行分离和干燥.(图中的a、b、c、d均为活塞,可以控制气体的通过和液体的加入,实验前活塞均已关闭.仪器的固定装置已经省略)请选择适宜的试剂完成上述实验.可供选择的试剂有:浓硫酸、稀硫酸、浓盐酸、稀盐酸、澄清的石灰水、氢氧化钠溶液、紫色石蕊试液.
则甲装置的烧瓶中盛放的试剂是
查看习题详情和答案>>
则甲装置的烧瓶中盛放的试剂是
氢氧化钠溶液
,乙装置中发生的化学反应是CO2+Ca(OH)2=CaCO3↓+H2O
,丙中盛放的试剂是浓硫酸
.实验开始时应先打开活塞ad
.
下列是实验室常用仪器装置图
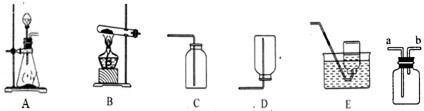
(1)B装置中试管口略向下倾斜的原因是
证明氧气已满的现象
(2)实验室利用过氧化氢溶液和二氧化锰混合制O2应选择制取装置
为防止反应速率过快,应提出的实验安全注意事项合理的是
①控制液体的滴加速率;②用体积小些的锥形瓶;③加热反应物
用此法代替加热分解高锰酸钾制O2的优点是
(3)甲烷(CH4)是一种无色、无味的气体,密度比空气小且极难溶于水,是天然气的主要成分.实验室制取甲烷气体常用无水醋酸钠(固体)和碱石灰(固体)加热制得.则实验室制取甲烷可选用的发生装置是
查看习题详情和答案>>

(1)B装置中试管口略向下倾斜的原因是
防止产生的水倒流,炸裂试管
防止产生的水倒流,炸裂试管
,如果用该装置来加热高锰酸钾制氧气,需要改进的地方是放一团棉花
放一团棉花
;用化学式写出反应表达式2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
,收集一瓶纯净的氧气应选择的装置
| ||
E
E
,(填字母)证明氧气已满的现象
将带火星木条横放瓶口,若木条复燃则已收集满
将带火星木条横放瓶口,若木条复燃则已收集满
.某同学收集一瓶干燥的氧气做蜡烛在氧气中燃烧的实验,应选择的收集装置C
C
(填字母).(2)实验室利用过氧化氢溶液和二氧化锰混合制O2应选择制取装置
AC或AE
AC或AE
,用化学式写出反应的表达式2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
,二氧化锰在该反应中起
| ||
催化
催化
作用.为防止反应速率过快,应提出的实验安全注意事项合理的是
①
①
(填编号).①控制液体的滴加速率;②用体积小些的锥形瓶;③加热反应物
用此法代替加热分解高锰酸钾制O2的优点是
不需要使用酒精灯加热;利用分液漏斗,控制液体的滴加速度,可使气流平稳生成
不需要使用酒精灯加热;利用分液漏斗,控制液体的滴加速度,可使气流平稳生成
(3)甲烷(CH4)是一种无色、无味的气体,密度比空气小且极难溶于水,是天然气的主要成分.实验室制取甲烷气体常用无水醋酸钠(固体)和碱石灰(固体)加热制得.则实验室制取甲烷可选用的发生装置是
B
B
,如果用图所示装置收集氨气,气体应从b
b
.(填a、b)端管口通入.
某校外化学兴趣小组同学学习化学积极性高,平时喜欢收集化学用品,建立了他们自己的实验室,其实验室中部分仪器如图.
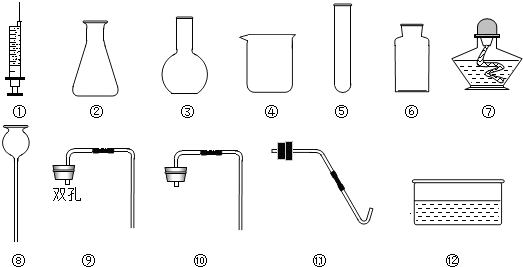
(1)①指出下列仪器名称:⑤ ;⑦ ;
②该小组同学经过认真讨论,一致认为从二氧化碳制取原理和溶解性角度考虑,在设计制取和收集二氧化碳的装置时,一定不会选用上述仪器中的 .(填序号)
③该小组小霞、小红和小华三位同学利用上述仪器各自设计出一种制取和收集二氧化碳的装置,用到的仪器如下:小霞:④⑥⑩小红:①②⑥⑨小华:②⑥⑧⑩
该组同学经过积极讨论和实验验证,大家一致认为小霞和小华设计的实验装置不能达到实验目的,那么请你也参与他们的讨论:
A.小霞同学实验不能达到目的原因是 .
小红同学要想顺利完成实验,有两种改进方法:即仪器①用仪器 替代,或用仪器 替代仪器⑨.
B.小红同学设计的装置还可以用来制取氧气,她采用的实验室制气原理为(用化学方程式表示) .
(2)小红同学为探究二氧化碳与水反应的生成物,做了如下实验:
向盛有石蕊试液的试管中通入二氧化碳,观察到紫色石蕊试液变成了红色.为了探究是什么物质使紫色石蕊变红了,小红同学作了大胆猜想,并用石蕊溶液染成紫色的干燥的小花设计了下列四个实验方案来验证自己的猜想(如图).
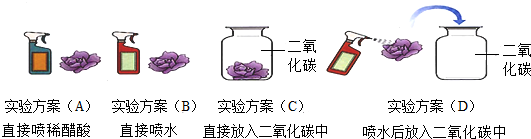
①请和小红同学一起完成下表.
②小红同学做了一个对比实验来确定CO2与水反应生成具有酸性的物质,此对比实验方案是 (填上图中的实验方案序号).
查看习题详情和答案>>

(1)①指出下列仪器名称:⑤
②该小组同学经过认真讨论,一致认为从二氧化碳制取原理和溶解性角度考虑,在设计制取和收集二氧化碳的装置时,一定不会选用上述仪器中的
③该小组小霞、小红和小华三位同学利用上述仪器各自设计出一种制取和收集二氧化碳的装置,用到的仪器如下:小霞:④⑥⑩小红:①②⑥⑨小华:②⑥⑧⑩
该组同学经过积极讨论和实验验证,大家一致认为小霞和小华设计的实验装置不能达到实验目的,那么请你也参与他们的讨论:
A.小霞同学实验不能达到目的原因是
小红同学要想顺利完成实验,有两种改进方法:即仪器①用仪器
B.小红同学设计的装置还可以用来制取氧气,她采用的实验室制气原理为(用化学方程式表示)
(2)小红同学为探究二氧化碳与水反应的生成物,做了如下实验:
向盛有石蕊试液的试管中通入二氧化碳,观察到紫色石蕊试液变成了红色.为了探究是什么物质使紫色石蕊变红了,小红同学作了大胆猜想,并用石蕊溶液染成紫色的干燥的小花设计了下列四个实验方案来验证自己的猜想(如图).

①请和小红同学一起完成下表.
| 猜想 | 实验方案 | 实验现象 | 结论 |
| 可能是CO2 使石蕊变红 | C | 紫色小花不变色 | |
| B | 紫色小花不变色 | 猜想错误 | |
| 可能是CO2 和水发生反应的生成物使石蕊变红 | 猜想正确 |
(2013?平江区二模)实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气,产物中还含有相对分子量最小的氧化物.进行实验时可选择的实验仪器如图所示(省略夹持装置与加热装置):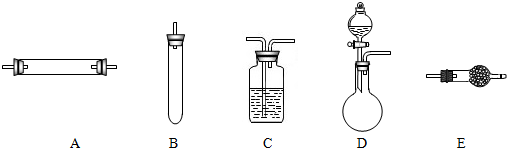
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置_
(3)方法三:制氮气的化学方程式为
(4)1892年,英国科学家瑞利(( Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大50‰.左右.若上述实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因:
查看习题详情和答案>>
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气,产物中还含有相对分子量最小的氧化物.进行实验时可选择的实验仪器如图所示(省略夹持装置与加热装置):

(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用
D
D
(选填装置编号).请写出生石灰在此反应中的作用:生石灰和水反应放热,促使氨水挥发、分解而得到氨气(或降低氨气的溶解度);生石灰与水反应,减少了溶剂
生石灰和水反应放热,促使氨水挥发、分解而得到氨气(或降低氨气的溶解度);生石灰与水反应,减少了溶剂
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置_
E
E
(选填装置编号)中加入碱石灰
碱石灰
以除去其它杂质气体.(3)方法三:制氮气的化学方程式为
NaNO2+NH4Cl
NaCl+N2↑+2H2O
| ||
NaNO2+NH4Cl
NaCl+N2↑+2H2O
.
| ||
(4)1892年,英国科学家瑞利(( Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大50‰.左右.若上述实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因:
方法二制得的氮气中含有密度(或相对分子质量)比氮气大的稀有气体,导致密度偏大
方法二制得的氮气中含有密度(或相对分子质量)比氮气大的稀有气体,导致密度偏大
.实验室常用氯化铵晶体和碱石灰(NaOH和CaO的混合物,有很强的吸水性,常作干燥剂)在加热的条件下,制取氨气(NH3),反应原理为NH4Cl+NaOH
NH3↑+NaCl+H2O.氨气极易溶于水,且能使湿润的紫色石蕊试纸变蓝,现结合下列实验装置(仪器)图回答有关何题:
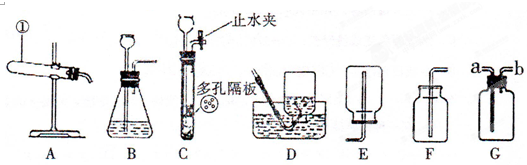
(1)制取氨气的装置应选择
(2)收集氨气的装置可选择
(3)浓硫酸
(4)收集氨气时验满的方法是
查看习题详情和答案>>
| ||

(1)制取氨气的装置应选择
A
A
(填番号),但缺少的仪器是酒精灯
酒精灯
(填名称);(2)收集氨气的装置可选择
E
E
(填“D”或“E”或“F”),如果选择了G,那么气体应由b
b
(填“a”或“b”)进入;(3)浓硫酸
不能
不能
(填能或不能)作干燥氨气的干燥剂,还可以选用碱石灰
碱石灰
(填名称)作干燥剂干燥氨气;(4)收集氨气时验满的方法是
将湿润的红色石蕊试纸靠近瓶口,变蓝即满
将湿润的红色石蕊试纸靠近瓶口,变蓝即满
.