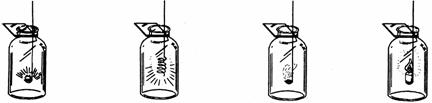
摘要:某同学做物质在氧气中燃烧的操作如下图所示.其中不合理的是 A B C D 木炭在氧气中燃烧 铁丝在氧气中燃烧 硫在氧气中燃烧 蜡烛在氧气中燃烧
网址:http://m.1010jiajiao.com/timu3_id_17764[举报]
某同学对蜡烛的燃烧进行探究:
①点燃一支蜡烛,用一只烧杯倒扣在燃着的蜡烛上,蜡烛燃烧片刻后熄灭,如实验一。
②再点燃蜡烛,然后吹灭,看到烛芯产生一缕白烟,用火柴点燃白烟,蜡烛重新被引燃,如实验二。
③将粗细均匀的木条水平放在蜡烛的火焰上,稍加热后观察木条燃烧现象,如实验三。

(1)操作①中,蜡烛能燃烧片刻的原因是 。
(2)操作②中,关于白烟的成分,有同学做出了下列猜想:A.白烟是水蒸气;B.白烟是石蜡固体小颗粒;C.白烟是二氧化碳。你认为上述猜想有道理的是(填序号) , 理由是 。
(3)该同学在做实验一的过程中,发现罩在火焰上方的烧杯内壁被熏黑,你认为她的以下做法中不合适的是( )
A.反复实验,并观察是否有相同现象
B.查找资料,了解石蜡的主要成分,探究生成的黑色固体是什么
C.认为与本次实验目的无关,不予理睬
D.询问老师或同学,讨论生成黑色物质的原因
(4)木条处于外焰的部分最先变黑,说明蜡烛的外焰温度最 。
查看习题详情和答案>>某化学兴趣小组利用下列装置进行O2、CO2的实验室制法和有关性质的研究.
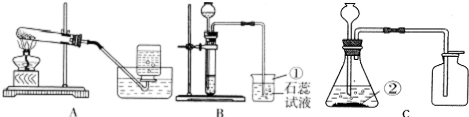
(1)写出下列编号仪器的名称:①
(2)甲同学要用高锰酸钾制取O2,可选用图中的
(3)查阅资料知:浓盐酸具有挥发性,能挥发出氯化氢.
①乙同学用浓盐酸和大理石在B装置中反应,制取CO2,并检验其有关性质时观察到烧杯中紫色石蕊试液变红.对这一变化的合理解释有
A、产生的CO2直接使石蕊试液变红
B、产生的CO2与水反应生成H2CO3使石蕊试液变红
C、挥发出的氯化氢溶于水使石蕊试液变红
②乙同学将制得的气体通入澄清的石灰水中,石灰水没有变浑浊,其原因是
(4)丙同学用C装置制取一瓶无色、无味的气体(纯净物),你推测该气体可能是
查看习题详情和答案>>

(1)写出下列编号仪器的名称:①
烧杯
烧杯
②锥形瓶
锥形瓶
.(2)甲同学要用高锰酸钾制取O2,可选用图中的
A
A
装置(填编号),该装置还需做何改进或补充:试管口放一团棉花
试管口放一团棉花
;该反应的化学方程式是2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.当O2收集满并取出集气瓶后,停止该实验的正确操作步骤的先后顺序是
| ||
先把导管移出水面,再熄灭酒精灯
先把导管移出水面,再熄灭酒精灯
_.(3)查阅资料知:浓盐酸具有挥发性,能挥发出氯化氢.
①乙同学用浓盐酸和大理石在B装置中反应,制取CO2,并检验其有关性质时观察到烧杯中紫色石蕊试液变红.对这一变化的合理解释有
BC
BC
(填序号).A、产生的CO2直接使石蕊试液变红
B、产生的CO2与水反应生成H2CO3使石蕊试液变红
C、挥发出的氯化氢溶于水使石蕊试液变红
②乙同学将制得的气体通入澄清的石灰水中,石灰水没有变浑浊,其原因是
挥发出的氯化氢气体与石灰水反应
挥发出的氯化氢气体与石灰水反应
.(4)丙同学用C装置制取一瓶无色、无味的气体(纯净物),你推测该气体可能是
氧气(或二氧化碳)
氧气(或二氧化碳)
,试用最简便的方法证实你的推测将带火星的木条放在集气瓶内,若木条复燃,说明是氧气(或向集气瓶内倒入适量的石灰水,若石灰水变浑浊,说明是二氧化碳)
将带火星的木条放在集气瓶内,若木条复燃,说明是氧气(或向集气瓶内倒入适量的石灰水,若石灰水变浑浊,说明是二氧化碳)
;若用C装置通过复分解反应制取某种气体,应选用的液体药品是稀盐酸
稀盐酸
;检验该气体是否收集满的方法是:将燃着的木条放在集气瓶口,火焰熄灭,说明CO2已集满
将燃着的木条放在集气瓶口,火焰熄灭,说明CO2已集满
.为探索物质在化学变化前后的质量关系,科学家做了大量实验.1673年,英国物理学家波义耳做了一个有名的实验.他将金属放在密闭容器中煅烧,煅烧后他立即打开容器盖进行称量,结果发现反应后的固体质量增加了.该实验导致波义耳未能发现质量守恒定律.之后俄国化学家罗蒙诺索夫在密闭玻璃瓶内燃烧金属,发现反应后质量不变,由此得出反应前后的质量守恒.
这两位科学家的实验相似,为何结论不同?某研究小组沿着科学家的足迹进行探究,请你完成以下相关内容:
(1)【交流讨论】两位科学家得出不同的结论究竟与哪些实验因素有关呢?
(2)【提出假设】若用同种金属,同一容器进行实验,两位科学家得出不同的结论主要是由于
(3)【实验验证】已知:钠在空气中受热燃烧生成过氧化钠固体.
(4)【得出结论】假设成立.
(5)依据以上实验事实,解释两位科学家的实验结论:
查看习题详情和答案>>
这两位科学家的实验相似,为何结论不同?某研究小组沿着科学家的足迹进行探究,请你完成以下相关内容:
(1)【交流讨论】两位科学家得出不同的结论究竟与哪些实验因素有关呢?
(2)【提出假设】若用同种金属,同一容器进行实验,两位科学家得出不同的结论主要是由于
反应容器敞开与密闭的差异
反应容器敞开与密闭的差异
的缘故.(3)【实验验证】已知:钠在空气中受热燃烧生成过氧化钠固体.
| 操作步骤及实验现象 | 简答 |
| (1)在底部铺有细沙的锥形瓶中,放入一小块金属钠,塞紧橡皮塞,称量,用砝码使天平平衡. | 称量前需 检查天平是否平衡 检查天平是否平衡 . |
| (2)取下锥形瓶,放在垫有石棉网的三角架上微热,观察到金属钠着火燃烧,冷却后,再称量. | 称量时观察到 天平保持平衡 天平保持平衡 . |
| (3)将锥形瓶瓶塞取出一会儿后,盖上瓶塞,再称量. | 称量时观察到 天平指针向左偏移 天平指针向左偏移 . |
(5)依据以上实验事实,解释两位科学家的实验结论:
波义尔在敞口容器中实验,消耗氧气后,又不断补充空气,因此质量增加;而罗蒙诺索夫是在密闭容器中进行,质量不变
波义尔在敞口容器中实验,消耗氧气后,又不断补充空气,因此质量增加;而罗蒙诺索夫是在密闭容器中进行,质量不变
.(一) 某化学兴趣小组的同学对教材中“测定空气里氧气含量”的实验做了改进,在密闭容器里进行磷的燃烧,以防止产生的白烟污染空气.他们设计了如图1所示实验:选用容积为50mL的试管作反应容器,选用50mL的注射器(开始时活塞处于20mL刻度处)来测量磷燃烧时所消耗氧气的体积.
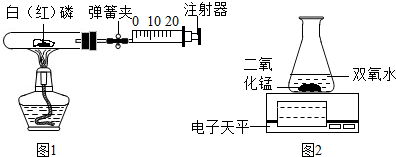
I.实验操作步骤如下:
①检查装置的气密性.
②装入药品,连接好仪器.
③夹紧弹簧夹,加热白磷,观察现象.
④等燃烧结束,试管冷却后打开弹簧夹,观察现象.
II.实验现象记录:
在步骤③中加热时观察到白磷燃烧,产生
在步骤④中待装置冷却后,打开弹簧夹,观察到活塞慢慢向
Ⅲ.实验结论:氧气占空气的体积分数约为
.
(二)另有化学兴趣小组的同学对实验室制备氧气的条件进行探究.
Ⅰ.为探究不同催化剂对氯酸钾分解速率的影响,甲组设计了以下两个对比实验:在相同的温度下,比较两组实验产生O2的快慢.
①将3.0g KClO3与1.0g MnO2均匀混合加热.
②将x g KClO3与1.0g CuO均匀混合加热.
(1)试写出实验①中所发生反应的化学方程式
(2)实验②中x的值应为
Ⅱ.为探究是否使用催化剂对双氧水(H2O2)分解速率的影响,乙组采用如图2装置,进行有催化剂和无催化剂时的对比实验.
实验中应记录的数据主要是反应时间和
Ⅲ.为探究的双氧水(H2O2)浓度对其分解速率的影响,丙组设计了以下实验.实验
数据记录如下:
(1)丙组实验中,测量O2体积的装置应选用
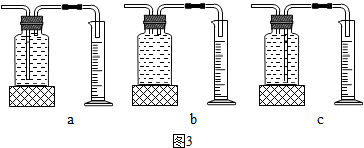
(2)丙组实验获得的结论:在相同条件下,
查看习题详情和答案>>

I.实验操作步骤如下:
①检查装置的气密性.
②装入药品,连接好仪器.
③夹紧弹簧夹,加热白磷,观察现象.
④等燃烧结束,试管冷却后打开弹簧夹,观察现象.
II.实验现象记录:
在步骤③中加热时观察到白磷燃烧,产生
白烟
白烟
.活塞开始时向不
不
移动(填“左”或“右”或“不”).在步骤④中待装置冷却后,打开弹簧夹,观察到活塞慢慢向
左
左
移动(填“左”或“右”),最终停在约10
10
mL刻度处(取整数值).Ⅲ.实验结论:氧气占空气的体积分数约为
| 1 |
| 5 |
| 1 |
| 5 |
(二)另有化学兴趣小组的同学对实验室制备氧气的条件进行探究.
Ⅰ.为探究不同催化剂对氯酸钾分解速率的影响,甲组设计了以下两个对比实验:在相同的温度下,比较两组实验产生O2的快慢.
①将3.0g KClO3与1.0g MnO2均匀混合加热.
②将x g KClO3与1.0g CuO均匀混合加热.
(1)试写出实验①中所发生反应的化学方程式
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
;
| ||
| △ |
(2)实验②中x的值应为
3.0
3.0
.Ⅱ.为探究是否使用催化剂对双氧水(H2O2)分解速率的影响,乙组采用如图2装置,进行有催化剂和无催化剂时的对比实验.
实验中应记录的数据主要是反应时间和
电子天平示数
电子天平示数
,可以通过比较单位时间内在锥形瓶
锥形瓶
中(填仪器名称)的物质质量变化的多与少,达到实验目的.Ⅲ.为探究的双氧水(H2O2)浓度对其分解速率的影响,丙组设计了以下实验.实验
数据记录如下:
| 序号 | 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2体积 |
| ① | 50.0g | 1% | 0.1g | 9mL |
| ② | 50.0g | 2% | 0.1g | 16mL |
| ③ | 50.0g | 4% | 0.1g | 31mL |
c
c
(填如图3中的字母编号).
(2)丙组实验获得的结论:在相同条件下,
双氧水的浓度越大
双氧水的浓度越大
,双氧水分解得越快.