网址:http://m.1010jiajiao.com/timu3_id_176835[举报]
现有一定量含有NaOH杂质的Na2O2试样5.00 g,分成等质量两份,用两种方法测定Na2O2试样的纯度。请填写下列空白:
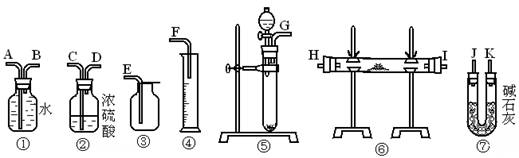
(1)第一种方法:取第一份试样,从下图中选用适当的实验装置,设计一个实验以测定过氧化钠的纯度(可供选用的反应物只有CaCO3固体、MnO2固体、6 mol·L-1盐酸和蒸馏水).

 ①若实验要求装置尽可能简单,应选用上图中的装置是(只要求写出图中装置的标号) 。
①若实验要求装置尽可能简单,应选用上图中的装置是(只要求写出图中装置的标号) 。
②所选用装置的连接顺序应是(填各接口的字母;连接胶管略). 。
③若实验过程中共产生氧气140 mL(已折算成标准状况),则试样中过氧化钠的纯度为 。
(2)第二种方法:取第二份试样,配成250.00 mL溶液,用0.255 0 mol·L-1的标准盐酸滴定。
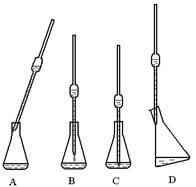
① 取上述所配溶液25.00 mL于锥形瓶中,操作如下图所示(手持部分省略):正确的操作是图 ,
取溶液所用仪器的名称是 。
② 滴定操作平行实验的数据记录如下表:
|
| 第一次滴定 | 第二次滴定 | 第三次滴定 |
| 消耗标准盐酸的体积(mL) | 24.98 | 25.00 | 25.02 |
由表中数据计算样品中Na2O2纯度为 。
(3)若上述两个实验中不存在重大的操作失误,测得的实验数据也是真实可靠的,但以上两种方法测得的Na2O2纯度数据误差较大。
① 你认为上述两种方法中,哪种方法更为可靠 ?
② 产生较大实验误差的原因最可能是 。
③ 在题中所给出的仪器和药品范围内,如何用简单的方法加以改进,使实验误差大为减少,写出改进的方法 。
查看习题详情和答案>>
(1)第一种方法:取第一份试样,从图1中选用适当的实验装置,设计一个实验以测定过氧化钠的纯度.

①若实验要求装置尽可能简单,应选用图1中的装置是(只要求写出图中装置的标号) .
②所选用装置的连接顺序应是(填各接口的字母;连接胶管略). .
③若实验过程中共产生氧气140mL(已折算成标准状况),则试样中过氧化钠的纯度为 .
(2)第二种方法:取第二份试样,配成250.00mL溶液,用0.255 0mol?L-1的标准盐酸滴定.
①取上述所配溶液25.00mL于锥形瓶中,操作如图2所示(手持部分省略):正确的操作是图 ,取溶液所用仪器的名称是 .
②滴定操作平行实验的数据记录如下表:
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 消耗标准盐酸的体积(mL) | 24.98 | 25.00 | 25.02 |
(3)若上述两个实验中不存在重大的操作失误,测得的实验数据也是真实可靠的,但以上两种方法测得的Na2O2纯度数据误差较大.
①你认为上述两种方法中,哪种方法更为可靠 ?
②产生较大实验误差的原因最可能是 .
③在题中所给出的仪器和药品范围内,如何用简单的方法加以改进,使实验误差大为减少,写出改进的方法 . 查看习题详情和答案>>
现有一定量含有NaOH杂质的Na2O2试样5.00 g,分成等质量两份,用两种方法测定Na2O2试样的纯度。请填写下列空白:
(1)第一种方法:取第一份试样,从下图中选用适当的实验装置,设计一个实验以测定过氧化钠的纯度(可供选用的反应物只有CaCO3固体、MnO2固体、6 mol·L-1盐酸和蒸馏水).
 ①若实验要求装置尽可能简单,应选用上图中的装置是(只要求写出图中装置的标号) 。
①若实验要求装置尽可能简单,应选用上图中的装置是(只要求写出图中装置的标号) 。
②所选用装置的连接顺序应是(填各接口的字母;连接胶管略). 。
③若实验过程中共产生氧气140 mL(已折算成标准状况),则试样中过氧化钠的纯度为 。
(2)第二种方法:取第二份试样,配成250.00 mL溶液,用0.255 0 mol·L-1的标准盐酸滴定。
① 取上述所配溶液25.00 mL于锥形瓶中,操作如下图所示(手持部分省略):正确的操作是图 ,
取溶液所用仪器的名称是 。
② 滴定操作平行实验的数据记录如下表:
|
|
第一次滴定 |
第二次滴定 |
第三次滴定 |
|
消耗标准盐酸的体积(mL) |
24.98 |
25.00 |
25.02 |
由表中数据计算样品中Na2O2纯度为 。
(3)若上述两个实验中不存在重大的操作失误,测得的实验数据也是真实可靠的,但以上两种方法测得的Na2O2纯度数据误差较大。
① 你认为上述两种方法中,哪种方法更为可靠 ?
② 产生较大实验误差的原因最可能是 。
③ 在题中所给出的仪器和药品范围内,如何用简单的方法加以改进,使实验误差大为减少,写出改进的方法 。
查看习题详情和答案>>
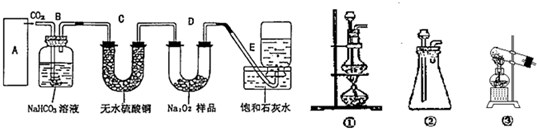
(1)请写出过氧化钠与二氧化碳反应的化学方程式,并标明电子转移的方向和数目:


(2)A中制取CO2的装置,应从下列图①、②、③中选哪个图:
(3)B装置的作用是
(4)为了检验E中收集到的气体,在取出集气瓶后,用
(5)若E中石灰水出现轻微白色浑浊,请说明原因:
(6)当D中的1.95g过氧化钠样品接近反应完毕时,你预测E装置内有何现象?
(7)反应完毕时,若测得E中的集气瓶收集到的气体为250mL,又知氧气的密度为1.43g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值
(20分)有一包从海水获得的粗盐,已经经过初步的提纯。课外活动小组对它的成分进行探究,并将粗盐进一步提纯。
探究一:这包粗盐中还有什么杂质?估计还含有氯化钙和氯化镁。
(1)现用实验验证推测:取样并溶解,加入几滴氢氧化钠溶液,目的是检验有没有___________________,接着再加数滴碳酸钠溶液,目的是检验有没有____________________。实验证明含有的杂质是氯化钙。
探究二:这包粗盐中氯化钠的质量分数是多少?接下面步骤继续实验:
①称取一定质量样品;
②将样品加水溶解;
③向粗盐溶液加入过量的某种试剂,过滤;
④沉淀洗涤后小心烘干,得到纯净固体A;
⑤滤液在进行某一操作后,移入蒸发皿蒸发,得到纯净固体B;
⑥称量实验中得到的某种固体。
(2)在②③⑤的步骤中,都使用到的同一仪器是____________,它在步骤②和⑤的操作方法相同,但目的不同,在步骤②的目的是_____________________,步骤⑤的目的是__________________________。(以上每空3分)
(3)在步骤③中加入的试剂是________________(2分)
(4)步骤⑥中,你认为需要称量的固体是A还是B____________,(1分)你不选择另一种的理由______________________。(2分)