摘要:23.据最新文献报道.可用如下步骤合成1,2-二溴乙烷:在装有温度计的干燥的三口烧瓶中.加入少许干沙.在室温下先向瓶中加入约l0 mL的无水乙醇和焦磷酸配成的混合溶液.加热到180 ℃-190 ℃.从滴液漏斗中开始滴加剩余的混合溶液.使反应平稳进行.乙烯气体经碱洗.干燥.通入装有液溴的反应瓶中.反应结束后.粗产品蒸馏.收集129 ℃-133 ℃的组分即得到产物1,2-二溴乙烷. ⑴由乙醇脱水得到乙烯的化学方程式是 .由乙烯合成1,2-二溴乙烷的化学方程式是 . ⑵如取59.8 g无水乙醇.55.2 g液溴.得到56.4 g产物.试计算1,2-二溴乙烷的产率.(产率=.计算结果取3位小数)
网址:http://m.1010jiajiao.com/timu3_id_176129[举报]
据最新科技报道,科学家发现了新型氢微粒,这种微粒是由3个氢原子核(只含质子)和2个电子构成的.对于这种微粒,下列说法中正确的是
[ ]
A.是氢的一种同素异形体
B.是氢的一种新的同位素
C.它的组成可用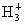 表示
表示
D.它比一个普通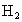 分子多一个氢原子
分子多一个氢原子
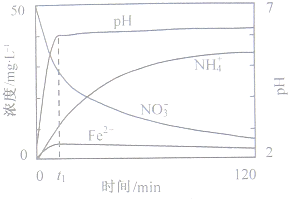 (2011?安徽)地下水中硝酸盐造成的氮污染已成为一个世界性的环节问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.
(2011?安徽)地下水中硝酸盐造成的氮污染已成为一个世界性的环节问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.(1)实验前:①先用0.1mol?L-1H2SO4洗涤Fe粉,其目的是
去除铁粉表面的氧化物等杂质
去除铁粉表面的氧化物等杂质
,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入N2
N2
(写化学式).(2)图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去).请根据图中信息写出t1时刻前该反应的离子方程式
4Fe+NO3-+10H+═4Fe2++NH4++3H2O
4Fe+NO3-+10H+═4Fe2++NH4++3H2O
.t1时刻后,改反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是生成的Fe2+水解
生成的Fe2+水解
.(3)改课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
假设一:溶液的pH;
假设二:
温度
温度
;假设二:
铁粉颗粒大小
铁粉颗粒大小
;(4)请你设计实验验证上述假设一,写出实验步骤及结论.(已知:溶液中的NO3-浓度可用离子色谱仪测定)
实验结论: