网址:http://m.1010jiajiao.com/timu3_id_175328[举报]
(1)取一定量没有变质纯净的Na2SO3?7H2O晶体,经600℃以上的强热至恒重,通过分析及计算表明,恒重后的样品质量恰好等于无水亚硫酸钠质量的计算值,而且各元素的组成也同样与亚硫酸钠组成符合.但将加热恒重后的样品溶于水,却发现溶液的碱性大大高于亚硫酸钠溶液的期望值.经过仔细思考,同学们提出了对这种反常现象的合理解析.
①你对这结论的解释是(用化学方程式表达)
②请设计相应的实验方案,验证以上的解释.(只要求写出实验设计的原理和判断结论,不要求具体的实验操作)
(2)为探究SO2与氯化钡溶液能否生成白色BaSO3沉淀,甲、乙两同学共同设计了下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验).关闭装置A中弹簧夹,滴加一定量浓硫酸,加热,A中有白雾生成,铜片表面产生气泡,B中有气泡冒出,产生大量白色沉淀,C中产生白色沉淀,液面上方略显浅棕色并逐渐消失.打开弹簧夹,通入N2,停止加热,一段时间后关闭.从B、C中分别取少量白色沉淀,加稀盐酸,均未发现白色沉淀溶解.

①写出构成装置A的玻璃仪器的名称
②A中发生反应的化学方程式是
③生成C中白色沉淀的离子方程式
④分析B中不溶于稀盐酸的沉淀产生的原因,请你提出合理的解释(只要求讲出一种情况)
⑤通过本实验探究,可以得出的结论是
A.预测物质的性质?
B.观察物质的外观性质?
C.进行实验和观察?
D.做出有关的解析和结论?
查看习题详情和答案>>(10分)A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素。其中A中含有5个原子核,它们之间有如下的反应关系:

(1)A、D的电子式分别为:A  ,D
,D 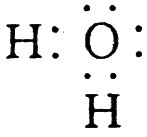 。
。
(2)B、C、D三种微粒结合质子能力x>y>z,(x、y、z分别代表B、C、D中的某一种微粒),则x、y、z分别代表的微粒符号为x OH- ,y NH3 ,z H2O 。
【解析】 A中含5个原子核,又由C+H+→A,推知A为NH![]() ,知C为NH3,B为OH-,D为H2O。
,知C为NH3,B为OH-,D为H2O。
(10分)主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,他们的原子序数之和是W原子序数的5倍,Z元素的基态原子的最外层一个未成对电子,在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素与X元素相比,电负性X大于W,下列能证明这一事实的是 (填选项序号)
A.常温下X单质的颜色比W单质的颜色深
B.X单质与W的氢化物剧烈反应,产生W的单质
C.X与W形成的化合物中X元素呈负价态
D.比较两元素的单质与氢气化合时得电子的数目
(2)化合物M的化学式为 ,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是 。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有 ,O—C—O的键角约为 ;
(3)灼烧含元素Z的盐,会使火焰呈现特殊的颜色,请用原子结构的知识解析其原因: 。
查看习题详情和答案>>