摘要:17. 锌锰干电池广泛应用于生活.生产和科研.扔弃废干电池.不但造成资源浪费.还可造成严重环境污染.综合利用废干电池.除回收金属和碳棒外.对其内部的粉状化合物的处理过程如下: 试回答下列问题: (1)锌锰干电池在使用过程中.负极发生的电极反应为 . (2)锌锰干电池内粉状化合物主要为MnO2 和NH4Cl糊.回收时得到的产品A的主要成分是 . .将其分离的方法是 . (3)回收得到的产品B是MnSO4.在生产过程中一般需将其转化为重要的化工原料MnCO3.按照绿色化学的原则.最理想的“原子经济 就是反应物的原子全部转化为期望的最终产物.你认为将MnSO4转化为MnCO3选用的反应物是 .得到的另一种最终产物的用途是 .
网址:http://m.1010jiajiao.com/timu3_id_173674[举报]
碳及其化合物有广泛的用途.
(1)在电化学中,常用碳作电极:
①在酸性锌锰干电池中,碳棒作 极.
②若用碳棒和铁棒做电极电解饱和食盐水生产烧碱时,碳棒作 极,反应的离子方程式 .
(2)将水蒸气通过红热的碳可产生水煤气:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 .
A.升高温度 B.增加碳的用量
C.加入催化剂 D.用CO吸收剂除去CO
(3)将一定量的CO(g)和H2O(g)通过某恒容的密闭容器中,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)得到如下数据:
通过计算,该反应的平衡常数为: .
(4)工业上把水煤气中的混合气体处理后,获得较纯的H2用于合成氨:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol某同学在不同实验条件下模拟化工生产进行实验,N2浓度随时间变化如图1:
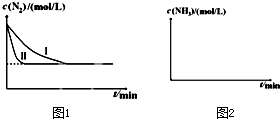
①与实验Ⅰ比较,实验Ⅱ改变的条件为: .
②实验Ⅲ比实验I的温度要高,其它条件相同,请在图2画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图.
查看习题详情和答案>>
(1)在电化学中,常用碳作电极:
①在酸性锌锰干电池中,碳棒作
②若用碳棒和铁棒做电极电解饱和食盐水生产烧碱时,碳棒作
(2)将水蒸气通过红热的碳可产生水煤气:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是
A.升高温度 B.增加碳的用量
C.加入催化剂 D.用CO吸收剂除去CO
(3)将一定量的CO(g)和H2O(g)通过某恒容的密闭容器中,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)得到如下数据:
| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
(4)工业上把水煤气中的混合气体处理后,获得较纯的H2用于合成氨:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol某同学在不同实验条件下模拟化工生产进行实验,N2浓度随时间变化如图1:

①与实验Ⅰ比较,实验Ⅱ改变的条件为:
②实验Ⅲ比实验I的温度要高,其它条件相同,请在图2画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图.
下列有关物质的性质与应用不相对应的是( )
| A、SO2具有氧化性,可用于漂白纸浆 | B、常温下,铝能被浓硝酸钝化,可用铝槽车运输浓硝酸 | C、K2FeO4具有强氧化性,可用于自来水的杀菌消毒 | D、Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |