摘要:: SO2+NOH = NaHSO3 SO2 + 2NaOH = Na2SO3 + H2O 答:每天至少需要氢氧化钠溶液500L
网址:http://m.1010jiajiao.com/timu3_id_172682[举报]
某校化学小组的同学用如图装置对铜与浓硫酸在一定条件下的反应进行实验探究,请回答:

(1)写出A试管中发生反应的化学方程式
(2)请填写表中空白:
(3)写出③中反应的离子方程式:
(4)在C方框内画出吸收尾气的装置图,并标出试剂名称.
查看习题详情和答案>>

(1)写出A试管中发生反应的化学方程式
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
;若有1摩铜完全反应,则被还原的H2SO4的物质的量为
| ||
1mol
1mol
.(2)请填写表中空白:
| B中棉花的位置 | ① | ② | ③ |
| 所蘸试剂 | 滴有酚酞的NaOH试液 | 品红溶液 | 淀粉和碘水混合液 |
| 现象 | 溶液红色消失 溶液红色消失 |
品红褪色 品红褪色 |
蓝色褪色 蓝色褪色 |
| 体现SO2的性质 | 酸性 酸性 |
漂白性 漂白性 |
还原性 还原性 |
SO2+I2+2H2O=4H++2I-+SO42-
SO2+I2+2H2O=4H++2I-+SO42-
.(4)在C方框内画出吸收尾气的装置图,并标出试剂名称.
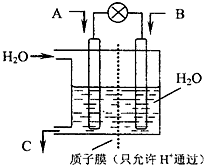 (2010?崇文区二模)面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.
(2010?崇文区二模)面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.(1)下列措施中,有利于降低大气中的SO2、NOx、CO2浓度的有
acd
acd
(选填字母).a.减少化石燃料的使用,加快开发和利用风能、氢能等新能源
b.使用无磷洗涤用品,减少含磷废物的排放
c.多步行或乘公交车,少用专车或私家车
d.在屋顶安装太阳能热水器为居民提供生活用热水
(2)用甲醇替代作为汽车燃料可降低汽车尾气污染.已知用合成气(CO和H2)合成1mol液态甲醇吸收热量为131.9kJ,2H2(g)+CO2(g)+
| 3 | 2 |
△H=-594.1kJ/mol,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1452kJ/mol
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1452kJ/mol
.(3)现欲以如图所示装置用电化学原理将CO2、SO2转化为重要化工原料.
①若A为CO2,B为H2,C为CH3OH则通入H2的一极为
负
负
极;②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为
SO2+2H2O-2e-=SO42-+4H+
SO2+2H2O-2e-=SO42-+4H+
.(4)①已知:密闭容器中,17℃、1.01×105Pa条件下,2NO2(g)?N2O4(g)△H<0的平衡常数K=13.3.
当此反应达到平衡时,若c(NO2)=0.030mol/L,则c(N2O4)=
0.012mol/L
0.012mol/L
(保留两位有效数字);②若改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO2)=0.04mol/L,c(N2O4)=0.007mol/L,则改变的条件是
升高温度
升高温度
.为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯(CH3CH2OH
CH2═CH2+H2O),将生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应.乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应.
(1)甲同学设计的实验
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的气体,未必是乙烯
D.使溴水褪色的气体,就是乙烯
(2)乙同学推测此乙烯中可能含有的一种杂质气体是
(3)为了验证乙烯与溴水的反应是加成反应而不是取代反应,可采取哪些方法?
查看习题详情和答案>>
| 稀硫酸 |
(1)甲同学设计的实验
不能
不能
(填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是AC
AC
(填编号).A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的气体,未必是乙烯
D.使溴水褪色的气体,就是乙烯
(2)乙同学推测此乙烯中可能含有的一种杂质气体是
SO2
SO2
,它与溴水发生反应的化学方程式是SO2+Br2+2H2O═2HBr+H2SO4
SO2+Br2+2H2O═2HBr+H2SO4
,在验证过程中必须全部除去.(3)为了验证乙烯与溴水的反应是加成反应而不是取代反应,可采取哪些方法?
由短周期元素组成的10种物质A~J间有下图所示的转化关系.已知A、B为同周期相邻元素的单质,其余均为化合物;通常状况下A为固体,B、D为气体,F为液体;A和G的浓溶液加热时反应生成D和F;J在光照时有I生成.试回答:

(1)写出下列物质的化学式:B
(2)反应①的离子方程式为
(3)足量铁与G的热的浓溶液反应所得气体是
(4)C是一种重要的化工产品,为易挥发的樱桃红色液体.若反应②中生成的G、A和I的物质的量之比为1:2:6,则C的电子式为
 ,反应②的化学方程式为
,反应②的化学方程式为
查看习题详情和答案>>

(1)写出下列物质的化学式:B
Cl2
Cl2
,ESO3
SO3
,F的结构式H-O-H
H-O-H
.(2)反应①的离子方程式为
HClO+SO2+H2O=3H++SO42-+Cl-
HClO+SO2+H2O=3H++SO42-+Cl-
;(3)足量铁与G的热的浓溶液反应所得气体是
SO2、H2
SO2、H2
;铁与B反应的化学方程式2Fe+3Cl2
2FeCl3
| ||
2Fe+3Cl2
2FeCl3
.
| ||
(4)C是一种重要的化工产品,为易挥发的樱桃红色液体.若反应②中生成的G、A和I的物质的量之比为1:2:6,则C的电子式为


3SCl2+4H2O=H2SO4+2S↓+6HCl
3SCl2+4H2O=H2SO4+2S↓+6HCl
.