摘要:23.反应3C12 + 8NH3= 6NH4Cl + N2可用于工业上检查氯气管道是否漏气.该反 应中.电子转移总数为 .参加反应的氨中.被氧化与未被氧化的氨的质量比是 具有耐高温.抗冲击.导热性好等优良性质.被广泛地应用于电子工业. 陶瓷工业等领域.在一定条件下.氮化铝可以通过如下反应合成: A1203 + N2 + 3C = 2AlN + 3C0 用双线桥法标示该反应中电子转移的方向和数目. (3)已知某温度时发生如下三个化学反应 ① C +C02=2CO:②C + H20=CO+H2 ; ③ C0 +H20=CO2+H2.由此判断.在该温度下.C.C0.H2的还原性由强到弱的顺序是 (4)已知5个RO32-与2个X04-恰好完全反应.氧化产物是RO42-.则还原产物中X元素的化合价是 价.
网址:http://m.1010jiajiao.com/timu3_id_172649[举报]
已知Co2O3在酸性溶液中易被还原成Co2+,且Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列叙述中,正确的是 ( )
A、Cl2通入FeI2溶液中,可存在反应3C12+6FeI2====2FeCl3+4FeI3
B、每1mol Co2O3在酸性溶液中被氧化生成Co2+时转移2 mol e-
C、FeCl3溶液能使淀粉KI试纸变蓝
D、I2具有较强的氧化性,可以将Co2+氧化成Co2O3
查看习题详情和答案>>某学生利用以下装置探究氯气和氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气和氨气的反应装置.
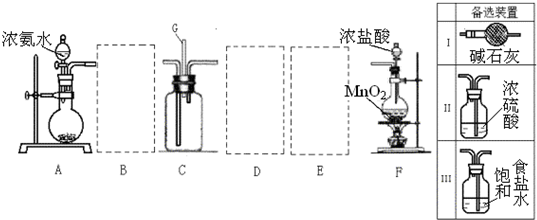
请回答下列问题:
(1)装置F中发生反应的离子方程式
(2)装置A中的烧瓶内固体可选用
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择.并将编号填入下列空格.
B
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,该反应的化学方程式为:
查看习题详情和答案>>

请回答下列问题:
(1)装置F中发生反应的离子方程式
MnO2+4H++2C1-
Mn2++C12↑+2H2O
| ||
MnO2+4H++2C1-
Mn2++C12↑+2H2O
.
| ||
(2)装置A中的烧瓶内固体可选用
ABE
ABE
(选填以下选项的代号)A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择.并将编号填入下列空格.
B
Ⅰ
Ⅰ
、DⅡ
Ⅱ
、EⅢ
Ⅲ
(填编号)(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,该反应的化学方程式为:
8NH3+3C12=6NH4C1+N2
8NH3+3C12=6NH4C1+N2
;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+.
将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+.
.无水AlCl3可用作有机合成的催化剂、食品膨松剂等.工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按如图所示流程进行一系列反应来制备无水AlCl3.

(1)AlCl3是
(2)化炉中Al2O3、C12和C反应的化学方程式是
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,写出此反应的离子方程式是
(4)华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是
(5)为测定无水AlCl3产品的纯度,现称取16.25g精制后的无水 AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.32g. 则AlCl3产品的纯度为
查看习题详情和答案>>

(1)AlCl3是
分子
分子
晶体.(2)化炉中Al2O3、C12和C反应的化学方程式是
A12O3+3C12+3C
2A1C13+3CO
| ||
A12O3+3C12+3C
2A1C13+3CO
.
| ||
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,写出此反应的离子方程式是
SO32-+C12+H2O═SO42-+2C1-+2H+
SO32-+C12+H2O═SO42-+2C1-+2H+
.(4)华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是
除去FeCl3
除去FeCl3
.(5)为测定无水AlCl3产品的纯度,现称取16.25g精制后的无水 AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.32g. 则AlCl3产品的纯度为
96%
96%
.(2012?门头沟区一模)无水AlCl3易升华,可用作有机合成的催化剂等.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是C)为原料制备无水AlCl3的工艺(碳氯化法)流程如下:
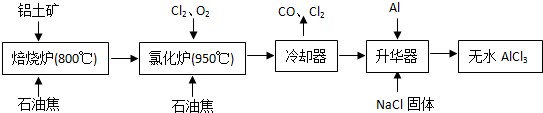
(1)氯化炉中Al2O3、Cl2和C反应的化学方程式为
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为
(3)升华器中主要含有AlCl3和FeCl3,需加入一定量Al,其目的是
(4)为测定制得的无水AlCl3产品(含少量FeCl3杂质)的纯度,称取16.25g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32g.
①此过程涉及反应的离子方程式为
②AlCl3产品的纯度为
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3?6H2O在氯化氢的气流中加热脱去结晶水而制得无水AlCl3,其原因是
查看习题详情和答案>>

(1)氯化炉中Al2O3、Cl2和C反应的化学方程式为
A12O3+3C12+3C
2A1C13+3CO
| ||
A12O3+3C12+3C
2A1C13+3CO
.
| ||
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为
SO32-+C12+H2O═SO42-+2C1-+2H+
SO32-+C12+H2O═SO42-+2C1-+2H+
.(3)升华器中主要含有AlCl3和FeCl3,需加入一定量Al,其目的是
除去FeCl3
除去FeCl3
.(4)为测定制得的无水AlCl3产品(含少量FeCl3杂质)的纯度,称取16.25g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32g.
①此过程涉及反应的离子方程式为
Fe3++3OH-=Fe(OH)3↓
Fe3++3OH-=Fe(OH)3↓
、Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
.②AlCl3产品的纯度为
96%
96%
.(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3?6H2O在氯化氢的气流中加热脱去结晶水而制得无水AlCl3,其原因是
Al3++3H2O?Al(OH)3+3H+,抑制AlCl3水解
Al3++3H2O?Al(OH)3+3H+,抑制AlCl3水解
.(2008?枣庄一模)某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应.其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置.

请回答下列问题:
(1)装置F中发生反应的离子方程式是
(2)装置A中的烧瓶内固体可选用
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的备选装置中选择,并将编号填入下列空格.B
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:
(5)若从装置C和G处逸出的尾气中含有N2和少量Cl2,应如何处理?
查看习题详情和答案>>

请回答下列问题:
(1)装置F中发生反应的离子方程式是
MnO2+4H++2C1-
Mn2++C12↑+2H2O
| ||
MnO2+4H++2C1-
Mn2++C12↑+2H2O
.
| ||
(2)装置A中的烧瓶内固体可选用
ACE
ACE
(选填以下选项的代号).A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的备选装置中选择,并将编号填入下列空格.B
Ⅱ
Ⅱ
、DⅢ
Ⅲ
、EⅠ
Ⅰ
.(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:
8NH3+3C12=6NH4C1+N2
8NH3+3C12=6NH4C1+N2
;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+
将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+
.(5)若从装置C和G处逸出的尾气中含有N2和少量Cl2,应如何处理?
将导气管与G口连接,另一端插入盛有NaOH溶液的烧杯中
将导气管与G口连接,另一端插入盛有NaOH溶液的烧杯中
.