摘要:16.CO+CuO △ Cu+CO2中.若生成的Cu和CO2的质量和为10.8 g.则参加反应的CuO的质量为 A. 64 g B. 8 g C. 16 g D. 2.8 g
网址:http://m.1010jiajiao.com/timu3_id_17246[举报]
小杰和小静学习了碳单质的化学性质后,知道碳与氧气反应能够生成CO或CO2.于是两人联想到木炭与氧化铜发生的反应可能有:
①2CuO+C
2Cu+CO2↑ ②CuO+C
Cu+CO↑
他们想来验证自己的想法,请你同他们一起进行探究.
【猜想与假设】木炭与氧化铜反应生成的产物有三种可能:
(1)产物是:铜和一氧化碳;
(2)产物是:铜和二氧化碳;
(3)产物是:______.
【设计方案】如何检验产物中有一氧化碳,两人查找了资料:一氧化碳的特征反应是使某种氯化钯的黄色混合液变蓝.
【实验与结论】设计的实验装置图如图所示
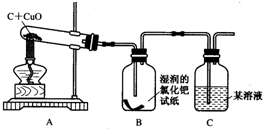
实验报告:
【反思与评价】
①实验结束时,为防止______,必须先停止加热,待铜冷却后再将试管口的胶塞取下,因此,若没有B安全瓶,可能导致的后果是______.
②根据实验结论,从环保角度考虑,上述装置C后的尾气处理方法是______,理由是______.
查看习题详情和答案>>
①2CuO+C
| 高温 |
| 高温 |
他们想来验证自己的想法,请你同他们一起进行探究.
【猜想与假设】木炭与氧化铜反应生成的产物有三种可能:
(1)产物是:铜和一氧化碳;
(2)产物是:铜和二氧化碳;
(3)产物是:______.
【设计方案】如何检验产物中有一氧化碳,两人查找了资料:一氧化碳的特征反应是使某种氯化钯的黄色混合液变蓝.
【实验与结论】设计的实验装置图如图所示

实验报告:
| 实 验 现 象 | 实 验 结 论 |
| ①A中固体由______色变为______色 ②B中黄色试纸变蓝 ③C中溶液变______ ④不断通入二氧化碳,C中又可观察到 ______ |
①有铜生成 ②有______生成 ③有二氧化碳生成,反应的化学方程式 ______ ④反应后生成新物质______ |
①实验结束时,为防止______,必须先停止加热,待铜冷却后再将试管口的胶塞取下,因此,若没有B安全瓶,可能导致的后果是______.
②根据实验结论,从环保角度考虑,上述装置C后的尾气处理方法是______,理由是______.
 城镇居民烧水做饭用的管道煤气的主要成分是CO,其中也含有一定量的H2和少量CO2与水蒸气.为了验证其中H2、CO2的存在和管道煤气的还原性,某同学设计了如所示的实验装置.已知B中所盛物质为浓H2SO4、E中所盛物质为过量的澄清石灰水.其他所需的药品请从下列试剂中选择:浓H2SO4、CuSO4粉末、NaOH溶液、澄清的石灰水(若需要,药品可重复选用).
城镇居民烧水做饭用的管道煤气的主要成分是CO,其中也含有一定量的H2和少量CO2与水蒸气.为了验证其中H2、CO2的存在和管道煤气的还原性,某同学设计了如所示的实验装置.已知B中所盛物质为浓H2SO4、E中所盛物质为过量的澄清石灰水.其他所需的药品请从下列试剂中选择:浓H2SO4、CuSO4粉末、NaOH溶液、澄清的石灰水(若需要,药品可重复选用).(1)写出A、D中盛放物质的名称或化学式:A
澄清石灰水
澄清石灰水
、DCuSO4粉末
CuSO4粉末
.(2)写出C、E中发生反应的化学方程式:
C:CuO+CO
Cu+CO2,CuO+H2
Cu+H2O;E:Ca(OH)2+CO2═CaCO3↓+H2O
| ||
| ||
C:CuO+CO
Cu+CO2,CuO+H2
Cu+H2O;E:Ca(OH)2+CO2═CaCO3↓+H2O
.
| ||
| ||
(3)请提出对F处尾气的处理方法:
烧掉
烧掉
.(4)请分析若将A、B装置中药品对换后对实验造成的影响:
A、B中药品交换后,进入C装置中的气体不干燥,导致对管道煤气中是否含H2的检验得不到准确结论,同时由于水蒸气的存在,将对C中的反应产生不良影响
A、B中药品交换后,进入C装置中的气体不干燥,导致对管道煤气中是否含H2的检验得不到准确结论,同时由于水蒸气的存在,将对C中的反应产生不良影响
.
城镇居民烧水做饭用的管道煤气的主要成分是CO,其中也含有一定量的H2和少量CO2与水蒸气.为了验证其中H2、CO2的存在和管道煤气的还原性,某同学设计了如所示的实验装置.已知B中所盛物质为浓H2SO4、E中所盛物质为过量的澄清石灰水.其他所需的药品请从下列试剂中选择:浓H2SO4、CuSO4粉末、NaOH溶液、澄清的石灰水(若需要,药品可重复选用).
(1)写出A、D中盛放物质的名称或化学式:A______、D______.
(2)写出C、E中发生反应的化学方程式:______ Cu+CO2,CuO+H2 Cu+H2O;E:Ca(OH)2+CO2═CaCO3↓+H2O
Cu+H2O;E:Ca(OH)2+CO2═CaCO3↓+H2O
 查看习题详情和答案>>
查看习题详情和答案>>
(1)写出A、D中盛放物质的名称或化学式:A______、D______.
(2)写出C、E中发生反应的化学方程式:______ Cu+CO2,CuO+H2
 Cu+H2O;E:Ca(OH)2+CO2═CaCO3↓+H2O
Cu+H2O;E:Ca(OH)2+CO2═CaCO3↓+H2O 查看习题详情和答案>>
查看习题详情和答案>>
(2008?百色)某化学兴趣小组的同学设计了实验室制取干燥氧气及验证碳和碳的氧化物性质的装置图,请你帮助他们完成下列问题:
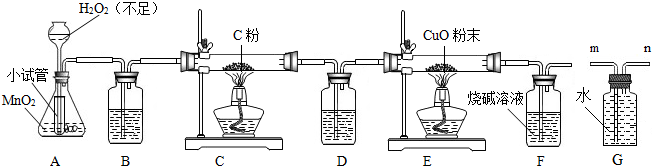
(1)写出用H2O2制取氧气的化学方程式:
(2)用B装置干燥氧气,应选用的试剂是(填序号)
(3)若E装置中的固体由黑色变红色,则发生反应的化学方程式是:
查看习题详情和答案>>

(1)写出用H2O2制取氧气的化学方程式:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
,A装置中小试管的作用是
| ||
可节约药品,且长颈漏斗下端伸入试管能起液封作用
可节约药品,且长颈漏斗下端伸入试管能起液封作用
.(2)用B装置干燥氧气,应选用的试剂是(填序号)
②
②
[①稀硫酸 ②浓硫酸 ③浓盐酸],C装置中发生的反应如果产生两种气体,要检验其中一种,D装置应装入的一种溶液是澄清石灰水
澄清石灰水
.(3)若E装置中的固体由黑色变红色,则发生反应的化学方程式是:
CuO+CO
Cu+CO2
| ||
CuO+CO
Cu+CO2
.试验产生的尾气排放到空气中会造成污染,用G装置收集尾气,则尾气应从
| ||
n
n
端进入(填m或n).现有一种不纯的氧化铜粉末样品(杂质为铜粉),小刚和小强通过实验测定样品中氧化铜的质量分数.(提示:CuO+CO
Cu+CO2)请你回答相关问题:
(1)小刚称取10g样品,利用下图所示装置进行实验,充分反应后,B装置增重4.4g,据此计算氧化铜样品中氧化铜的质量分数.
解: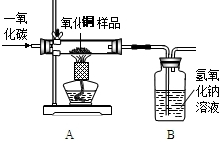
答:
(2)小强同学用同样的装置进行实验,实验结果与小刚所得的正确结果比较,出现偏差,请你分析造成误差的可能原因
(3)小刚是利用还原氧化铜的原理进行测定,请你简要写出其他测定样品中氧化铜的质量分数的方法和要测定的数据.(用文字叙述,无需写出具体质量数值)
查看习题详情和答案>>
| ||
(1)小刚称取10g样品,利用下图所示装置进行实验,充分反应后,B装置增重4.4g,据此计算氧化铜样品中氧化铜的质量分数.
解:
B装置增重4.4g,为反应生成的二氧化碳的质量,设参见反应氧化铜的质量为x.
CuO+CO
Cu+CO2
8044
x 4.4g
=
解得x=8.0g
该样品中氧化铜的质量分数=
×100%=80%
CuO+CO
| ||
8044
x 4.4g
| 80 |
| 44 |
| x |
| 4.4g |
解得x=8.0g
该样品中氧化铜的质量分数=
| 8.0g |
| 10g |
B装置增重4.4g,为反应生成的二氧化碳的质量,设参见反应氧化铜的质量为x.
CuO+CO
Cu+CO2
8044
x 4.4g
=
解得x=8.0g
该样品中氧化铜的质量分数=
×100%=80%
CuO+CO
| ||
8044
x 4.4g
| 80 |
| 44 |
| x |
| 4.4g |
解得x=8.0g
该样品中氧化铜的质量分数=
| 8.0g |
| 10g |

答:
该样品中氧化铜的质量分数80%
该样品中氧化铜的质量分数80%
(2)小强同学用同样的装置进行实验,实验结果与小刚所得的正确结果比较,出现偏差,请你分析造成误差的可能原因
若过早停止通氢气,使氧化铜没有被完全还原
若过早停止通氢气,使氧化铜没有被完全还原
.(3)小刚是利用还原氧化铜的原理进行测定,请你简要写出其他测定样品中氧化铜的质量分数的方法和要测定的数据.(用文字叙述,无需写出具体质量数值)
先测出氧化铜样品的质量,再测出氧化铜样品和玻璃管的质量,然后通一氧化碳气体使其和氧化铜完全反应,实验结束后测固体和玻璃管的质量,根据质量减少的部分是氧化铜中氧元素的质量,计算出氧化铜的质量,再根据质量分数公式计算样品中氧化铜的质量分数
先测出氧化铜样品的质量,再测出氧化铜样品和玻璃管的质量,然后通一氧化碳气体使其和氧化铜完全反应,实验结束后测固体和玻璃管的质量,根据质量减少的部分是氧化铜中氧元素的质量,计算出氧化铜的质量,再根据质量分数公式计算样品中氧化铜的质量分数
.