摘要:24.指出下列原子的电子排布中.违反了哪些规律. ⑴ ⑵ ⑶ ⑷
网址:http://m.1010jiajiao.com/timu3_id_172342[举报]
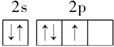
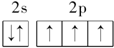
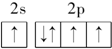
指出下列原子的电子排布中,违背了哪些规律.
(1)![]()
____________________
(2)![]()
____________________
(3)![]()
____________________
(4)![]()
____________________
写出下列原子的电子排布式并指出它们在周期表中的位置。
(1)Cu____________________第____周期____族
(2)Cr____________________第____周期____族
(3)Se____________________第____周期____族
(4)Zn____________________第____周期____族
(5)Fe____________________第____周期____族
查看习题详情和答案>>
(1)Cu____________________第____周期____族
(2)Cr____________________第____周期____族
(3)Se____________________第____周期____族
(4)Zn____________________第____周期____族
(5)Fe____________________第____周期____族
下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回答下列各小题:
(1)在以上表格中所有元素里基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称).
(2)根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,则属于s区的元素有 种,属于d区的元素有 种.第二周期元素中除Ne外电负性由高到低的三种元素依次是 ,电离能由高到低的三种元素依次是 .
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:
Mn元素的电子排布式为 ,
Fe2+的价电子排布图为 ,
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是: .
查看习题详情和答案>>
(2)根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,则属于s区的元素有
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| 电离能 ( kJ?mol-1) |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
Mn元素的电子排布式为
Fe2+的价电子排布图为
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是: