网址:http://m.1010jiajiao.com/timu3_id_172263[举报]
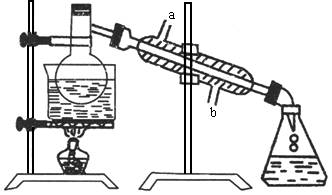
如图所示的仪器装置,在蒸馏瓶中有冰醋酸、乙醇、浓硫酸和碎瓷片,水浴加热,制粗乙酸乙酯。反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层。现用两种方法检验乙酸乙酯层和水层。第一种方法加入几滴KMnO4溶液,结果两层没有颜色,无法区别。第二种方法是加入少量碘片,结果上层颜色呈紫色。在该试验中:
(1)水浴的作用________;碎瓷片的作用________。
(2)冷凝水流经冷凝器时应从________进入________流出(填“a”或“b”)。
(3)烧杯中乙酸乙酯在________,根据________,加入几滴KMnO4溶液后,水层不显紫色是因为:________________。
(4)粗制乙酸乙酯经过提纯,可得到较为纯净的酯,提纯的操作方法是:________________________。
四、(本题包括4小题,共34分)
查看习题详情和答案>>
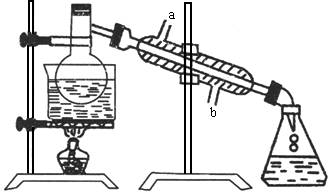
(1)水浴的作用________;碎瓷片的作用________。
(2)冷凝水流经冷凝器时应从________进入________流出(填“a”或“b”)。
(3)烧杯中乙酸乙酯在________,根据________,加入几滴KMnO4溶液后,水层不显紫色是因为:________________。
(4)粗制乙酸乙酯经过提纯,可得到较为纯净的酯,提纯的操作方法是:________________________。
四、(本题包括4小题,共34分)
查看习题详情和答案>>
包括3小题,(共10分)
(1)1mol H2SO4中约含有 个H2SO4, mol H , mol O
(2)9.03×1023个CO2的物质的量是 mol,在标准状况下的体积 L, 质量是是 克。
(3)在100mL2mol/LH2SO4溶液中,H2SO4的质量是 克。H+的物质的量浓度为 。
(4)质量分数为36.5%、密度为1.18g/cm3的浓盐酸中HCl的物质的量浓度为 。
查看习题详情和答案>>