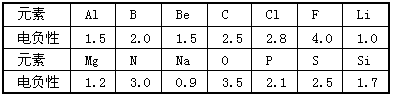
摘要:23.已知元素的电负性和原子半径一样.也是元素的一种基本性质.下表给出14种元素的电负性: 元素 Al B Be C Cl F Li Mg N Na O P S Si 电负性 1.5 2.0 1.5 2.5 2.8 4.0 1.0 1.2 3.0 0.9 3.5 2.1 2.5 1.7 试结合元素周期律知识完成下列问题: 根据上表给出的数据.可推知元素的电负性具有的变化规律是: .
网址:http://m.1010jiajiao.com/timu3_id_172248[举报]
已知元素的电负性和原子半径一样,也是元素的一种基本性质。下表给出14种元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
试结合元素周期律知识完成下列问题:
根据上表给出的数据,可推知元素的电负性具有的变化规律是_______________________。
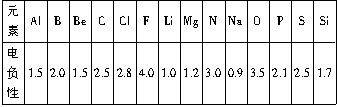
已知元素的电负性和原子半径一样,也是元素的一种基本性质。下面给出14种元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
试结合元素周期律知识完成下列问题。
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是:
_____________________________________________________________________。
(2)由上述变化规律可推知,短周期主族元素中,电负性最大的元素是__________,电负性最小的元素是__________,由这两种元素构成的化合属于__________ (填“离子”或“共价”)化合物,并用电子式表示该化合物的形成过程:_______________________________________。
查看习题详情和答案>>已知元素的电负性和原子半径一样,也是元素的一种基本性质,下面给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |
(2)预测Br与I元素电负性的大小关系是__________________,电负性最小的元素在周期表中的位置是________________________。(放射性元素除外)
(3)离子化合物和共价化合物之间没有绝对的界限,习惯上把SrI2看作离子化合物,把BaS看作共价化合物。(电负性:Sr=0.95;I=2.66;Ba=0.89;S=2.58)我们把两成键原子的电负性差值用△X表示,请找出用△X来判断离子键或共价键的数值范围:
即当△X___________时一般为共价键,当△X___________时一般为离子键。试判断AlBr3中化学键的类型是__________。 查看习题详情和答案>>