摘要:某溶液中可能含有Na+.K+.ClO-.SO42-.CO32-等离子中的全部或其中的几种.为确定其成分.现进行以下的连续操作:Ⅰ:用洁净的铂丝蘸取溶液在无色火焰上灼烧.火焰呈黄色,Ⅱ:取少量溶液.加入稀硫酸酸化.无气体放出.再滴入数滴品红溶液.振荡后品红褪色,Ⅲ:向Ⅱ反应后的溶液中加入Ba(NO3)2溶液.产生白色沉淀.试填写下列空白: (1) 原混合液中一定存在的离子是 .一定不存在的离子是 . (2) 上述Ⅰ-Ⅲ的操作中. 是错误的.应改为加 试剂以便确定 离子是否存在. (3) 为确定 离子是否存在.应补充的操作是 . 18.硝酸是一种挥发性强酸.而且不稳定.见光或受热时容易分解.硝酸浓度越高越易分解.分解产生NO2 .O2 .H2O.某校化学课外兴趣小组同学在做铜与浓硝酸.稀硝酸反应实验时发现:“相同质量的铜分别与等体积足量的浓硝酸.稀硝酸充分反应后.前者溶液颜色是绿色的.后者溶液的颜色是蓝色的. (1)一种观点认为:这可能是Cu2+浓度差异所致.你同意这种看法吗? .原因是 , (2)另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的二氧化氮溶于过量浓硝酸显黄色.加上和蓝色的硝酸铜溶液混在一起.使溶液呈绿色.为了验证推断是否正确.甲.乙.丙三位同学分别设计了三种方案进行验证: 甲同学方案:将盛绿色溶液的试管加热.看是否有红棕色气体产生. 乙同学方案:用双氧水和二氧化锰制得氧气.并把氧气通入绿色溶液中.观察其溶液是否变蓝色. 丙同学方案:在通风橱内.将一根下端弯成螺旋状且可抽动的铜丝插在盛有足量浓硝酸的试管甲中.立即可观察到试管中充满红棕色的NO2气体.将气体经导管通入到倾斜的另一支盛有淡蓝色Cu(NO3)2试管乙内.随着实验进行.试管乙中的溶液蓝色加深.很快又变成绿色.继续通入NO2.绿色保持不变.向上抽起铜丝.使反应停止. 请根据以上三位同学的方案回答下列问题: ①甲同学方案有明显不妥之处.试从化学实验方案的科学性给以说明: . ②请用化学方程式表示乙同学方案中的反应原理 . ③根据丙同学的实验方案进行操作.若出现的现象与其叙述的现象相同.则能否证明第二种观点是正确? , ④从环保的角度看.你认为三个方案中最好的是哪一个 .其理由是 .
网址:http://m.1010jiajiao.com/timu3_id_171724[举报]
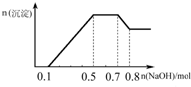 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A、溶液中的阳离子只有H+、Mg2+、Al3+ | B、溶液中n(NH4+)=0.2mol | C、溶液中一定不含CO32-,可能含有SO42-和NO3- | D、三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=1:1:1 |
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
查看习题详情和答案>>
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32−、SO42−、NO3−中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是
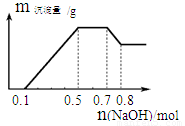
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH4+)=0.2mol
C.溶液中一定不含CO32−,可能含有SO42−和NO3−
D.三种离子的物质的量之比:n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1
查看习题详情和答案>>
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32?、SO42?、NO3?中的几种。
①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH4+)=0.2mol
C.溶液中一定不含CO32?,可能含有SO42?和NO3?
D.三种离子的物质的量之比:n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1
查看习题详情和答案>>
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32?、SO42?、NO3?中的几种。
①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是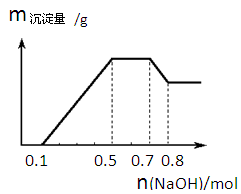
| A.溶液中的阳离子只有H+、Mg2+、Al3+ |
| B.溶液中n(NH4+)=0.2mol |
| C.溶液中一定不含CO32?,可能含有SO42?和NO3? |
| D.三种离子的物质的量之比:n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1 |