网址:http://m.1010jiajiao.com/timu3_id_169058[举报]
 (2009?泰州模拟)二氧化硫是常用的化工原料,但也是大气的主要污染物.
(2009?泰州模拟)二氧化硫是常用的化工原料,但也是大气的主要污染物.(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)
| 催化剂 | △ |
某温度下,将SO2和O2按体积比2:1充入密闭容器中,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示.根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.平衡时c(SO3)=
②达到平衡状态B,O2的转化率α(O2)=
(2)因为SO2排放造成的环境问题有
a.光化学烟雾 b.酸雨 c.赤潮 d.破坏臭氧层
(3)大气中的SO2主要源于化石燃料的燃烧和含硫矿石的冶炼.在SO2污染的治理中湿法石灰石-石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法.其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏(CaSO4?2H2O),烟气脱硫后排入大气.
①写出湿法石灰石-石膏法脱硫所涉及的化学反应方程式
②烟气在通入石灰石的浆液前通过热交换器的目的是
(1)小组一同学初步分析得出,该城市空气污染的主要原因有:
A、城市附近工厂排放的废气
B、燃烧含硫煤
C、粉尘污染
根据城市交通发展情况,另一同学认为还有一个不可排除的原因是: D____________
(2)研究小组对上面A、B、C、D四种主要原因,对100名市民和100名环保人士又进行了调查,结果如下图:

(3)空气污染形成酸雨。研究性学习小组对该城市的雨水进行了采样和分析,刚采集时测得PH为4.82,放在烧杯中经2小时后,再次测得pH为4.68,较长一段时间后发现pH不再变化,对此,你的合理解释是___________________________
(4)在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得 超过0.02mg/L。研究小组拟用下列简易装置测定空气中的SO2 含量:准确移取50mL5×10-4mol/L的碘溶液,注入下图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。

②如果甲同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出合理假设:________________。
(14分)二氧化硫和氮的氧化物是重要的化工原料,同时也是造成大气污染的主要物质。对其性质的研究是化学的重要任务。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)N2O5在四氯化碳溶液中的分解反应为:2N2O5=4NO2+O2。实验测得在67℃时反应体系中N2O5的物质的量浓度随时间的变化如下表所示。
|
t/min |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(N2O5)/mol·L—1 |
1.00 |
0.71 |
0.50 |
0.35 |
0.25 |
0.17 |
①实验进行的前1分钟和最后1分钟,用N2O5的物质的量浓度变化表示的平均反应速率分别是 、 。
②实验进行的最后1分钟,用NO2的物质的量浓度变化表示的平均反应速率是 ;5分钟时NO2的物质的量浓度是 。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中放出的热量为____kJ。
查看习题详情和答案>>
(14分)二氧化硫和氮的氧化物是重要的化工原料,同时也是造成大气污染的主要物质。对其性质的研究是化学的重要任务。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。根据图示回答下列问题:
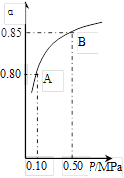
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)N2O5在四氯化碳溶液中的分解反应为:2N2O5=4NO2+O2。实验测得在67℃时反应体系中N2O5的物质的量浓度随时间的变化如下表所示。
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/mol·L—1 | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①实验进行的前1分钟和最后1分钟,用N2O5的物质的量浓度变化表示的平均反应速率分别是 、 。
②实验进行的最后1分钟,用NO2的物质的量浓度变化表示的平均反应速率是 ;5分钟时NO2的物质的量浓度是 。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中放出的热量为____kJ。
查看习题详情和答案>>
(14分)二氧化硫和氮的氧化物是重要的化工原料,同时也是造成大气污染的主要物质。对其性质的研究是化学的重要任务。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)N2O5在四氯化碳溶液中的分解反应为:2N2O5=4NO2+O2。实验测得在67℃时反应体系中N2O5的物质的量浓度随时间的变化如下表所示。
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/mol·L—1 | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②实验进行的最后1分钟,用NO2的物质的量浓度变化表示的平均反应速率是 ;5分钟时NO2的物质的量浓度是 。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中放出的热量为____kJ。 查看习题详情和答案>>
