摘要:23.漂白粉的有效成分是 .在酸性溶液中.可以生成具有强氧化性的 .有漂白.杀毒作用..在空气中起漂白作用的化学方程式是 .
网址:http://m.1010jiajiao.com/timu3_id_168504[举报]
漂白粉是一种常用杀菌、消毒剂,其有效成分为次氯酸钙.下图为制取漂白粉的工业流程简图.
| 信息卡 常温下碳酸钙难溶于水,氢氧化钙微溶于水,氯化钙易溶于水.次氯酸钙易溶于水,酸性条件下不稳定、100°C时发生分解反应. 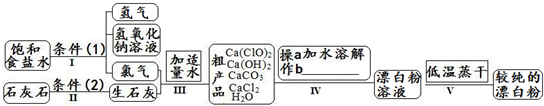 (1)流程I 得到浓度为80g?L-1氢氧化钠溶液,其物质的量浓度是 2 2 mol?L-1.(2)写出流程I发生反应的化学反应方程式,并用双线桥表示其电子转移的方向和数目:   高温 高温 .(3)流程III中发生两个反应,写出其中的氧化还原反应的化学反应方程 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O .其中氧化剂是Cl2 Cl2 ;还原剂是Cl2 Cl2 .(写化学式)(4)流程IV中操作b是: 过滤 过滤 .(写名称)(5)流程V进行低温蒸干的原因是: Ca(ClO)2在100°C时发生分解反应 Ca(ClO)2在100°C时发生分解反应 .(6)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因 Ca(ClO)2+CO2+H2O═CaCO3+2HClO Ca(ClO)2+CO2+H2O═CaCO3+2HClO .(7)氯水和次氯酸钙都能起漂白、消毒作用.是因为它们都能产生同一种物质,写出氯气与水反应产生该物质的化学方程式 Cl2+H2O  HCl+HClO HCl+HClOCl2+H2O . HCl+HClO HCl+HClO(8)在酸性条件下次氯酸钙的氧化性比氯气强,能将溴离子氧化成溴单质,而次氯酸钙中的氯元素则被还原为负一价的氯离子,氧元素则转化为水.试写出次氯酸钙和稀盐酸的混合物与溴化钠反应的化学方程式: Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O .
查看习题详情和答案>>
漂白粉是一种常用杀菌、消毒剂,其有效成分为次氯酸钙.下图为制取漂白粉的工业流程简图.
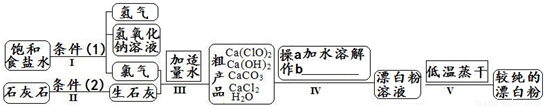 (1)流程I 得到浓度为80g?L-1氢氧化钠溶液,其物质的量浓度是______ mol?L-1. (2)写出流程I发生反应的化学反应方程式,并用双线桥表示其电子转移的方向和数目:______.流程II的反应条件(2)是______. (3)流程III中发生两个反应,写出其中的氧化还原反应的化学反应方程______.其中氧化剂是______;还原剂是______.(写化学式) (4)流程IV中操作b是:______.(写名称) (5)流程V进行低温蒸干的原因是:______. (6)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因______. (7)氯水和次氯酸钙都能起漂白、消毒作用.是因为它们都能产生同一种物质,写出氯气与水反应产生该物质的化学方程式______. (8)在酸性条件下次氯酸钙的氧化性比氯气强,能将溴离子氧化成溴单质,而次氯酸钙中的氯元素则被还原为负一价的氯离子,氧元素则转化为水.试写出次氯酸钙和稀盐酸的混合物与溴化钠反应的化学方程式:______. 查看习题详情和答案>> 按要求完成下列问题:
查看习题详情和答案>>
(1)工业上通常把氯气通入石灰乳中来制漂白粉,该反应的化学方程式为 2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O 2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O ,还原剂是Cl2 Cl2 .(2)现有:①石灰水; ②水玻璃; ③氯化钡溶液.在上面四种溶液分别通入过量的CO2后,能产生白色浑浊有 ② ② (填序号);所发生反应离子方程式为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3- SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3- .(3)硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,而硫酸铁则无这种药效.当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是 保护FeSO4不被空气中的氧气氧化成Fe2(SO4)3 保护FeSO4不被空气中的氧气氧化成Fe2(SO4)3 .如果药片已经失效,应如何检验?简述主要步骤:取少量研碎的药片放入烧杯中,加适量的水溶解,然后滴加几滴KSCN溶液 然后滴加几滴KSCN溶液 ;现象和结论反应后溶液显血红色,则表明该药片已经失效 反应后溶液显血红色,则表明该药片已经失效 . |