摘要: 下列说法正确的是 A. Cl和Cl-的化学性质相同 B. 含有氯元素的物质都呈黄绿色.均有毒 C. 氢气在氯气中燃烧时.火焰呈淡蓝色 D. 向氯水中滴加硝酸银溶液.有白色沉淀生成
网址:http://m.1010jiajiao.com/timu3_id_168370[举报]
下列说法正确的是( )
A.Cl和Cl―的化学性质相同
B.含有氯元素的物质都呈黄绿色,均有毒
C.氢气在氯气中燃烧时,火焰呈淡蓝色
D.向氯水中滴加硝酸银溶液,有白色沉淀生成
查看习题详情和答案>>|
下列说法正确的是 ①活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同 ②第ⅠA族元素铯的两种同位素137Cs比133Cs多4个质子 ③因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S ④泥水、淀粉溶液、盐酸分别属于悬浊液、胶体、溶液 ⑤碳酸氢根离子的电离方程式:HCO ⑥从上到下,卤族元素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱 ⑦500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g) | |
| [ ] | |
A. |
全部 |
B. |
④⑤ |
C. |
②③④⑦ |
D. |
②④⑦ |
下列说法中,正确的是
| A.35Cl、37 Cl为互为同位素,有不同的化学性质 |
| B.氯气和二氧化硫使品红褪色的原理相同 |
| C.浓硝酸和浓硫酸在空气中放置一段时间后浓度都会降低 |
| D.卤化氢在空气中都能形成白雾,它们都是强电解质 |
下列说法中,正确的是
| A.35Cl、37 Cl为互为同位素,有不同的化学性质 |
| B.氯气和二氧化硫使品红褪色的原理相同 |
| C.浓硝酸和浓硫酸在空气中放置一段时间后浓度都会降低 |
| D.卤化氢在空气中都能形成白雾,它们都是强电解质 |
[化学-物质结构与性质]
铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
(1)基态铬原子的价电子排布式为 .
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂.制备CrO2Cl2的反应为:K2 Cr2O2+3CCl4 2KC+2CrO2Cl2+3COCl2↑.
①上述反应式中非金属元素电负性由大到小的顺序是 (用元素符号表示).
②常温时CrO2Cl2是一种易溶于CCl4的液体,则固态CrO2Cl2属于 晶体.
③COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 .
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm.则熔点:NiO FeO(填”<”、“=”或“>”).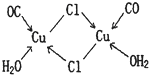
(4)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2?2H2O],其结构如图.下列说法不正确的是 .(填标号)
A.该复合物中存在化学健类型只有离子键、配位键
B.该复合物中Cl原子的杂化类型为sp3
C.该复合物中只有CO和H2O作为配位体
D.CO与N2的价电子总数相同,其结构为C≡O
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 .
查看习题详情和答案>>
铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
(1)基态铬原子的价电子排布式为
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂.制备CrO2Cl2的反应为:K2 Cr2O2+3CCl4 2KC+2CrO2Cl2+3COCl2↑.
①上述反应式中非金属元素电负性由大到小的顺序是
②常温时CrO2Cl2是一种易溶于CCl4的液体,则固态CrO2Cl2属于
③COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm.则熔点:NiO

(4)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2?2H2O],其结构如图.下列说法不正确的是
A.该复合物中存在化学健类型只有离子键、配位键
B.该复合物中Cl原子的杂化类型为sp3
C.该复合物中只有CO和H2O作为配位体
D.CO与N2的价电子总数相同,其结构为C≡O
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是