网址:http://m.1010jiajiao.com/timu3_id_168021[举报]
B.Na+、OH-、NO3-
C.Na+、SO42-、HCO3-
D.H+、SiO32-、Cl-
某一无色透明溶液中可能存在H+、Ba2+、Mg2+、Cu2+、OH-、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或几种.已知该溶液能与Al反应放出H2.
中的一种或几种.已知该溶液能与Al反应放出H2.
(1)若反应生成Al3+,则原溶液中一定存在和可能存在的离子有________.
(2)若反应生成![]() ,则原溶液中一定存在和可能存在的离子有________.
,则原溶液中一定存在和可能存在的离子有________.
某化学兴趣小组做了如下三个实验:
实验A:集气瓶中放青色、未熟的水果(蔬菜),盖上玻璃片;
实验B:集气瓶中放青色、未熟的水果(蔬菜),通入一定量的乙烯;
实验C:集气瓶中放青色、未熟的水果(蔬菜),瓶底放少量KMnO4固体,盖上玻璃片.
请根据所学化学知识完成下列问题:
(1)预期实验结果:水果成熟的先后顺序是
(2)解释你的预期结果的原因
为探究 Na、Mg、Al的金属活动性顺序,某课外小组同学进行了如下实验:
| 实验步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中; 2将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液; 3将一小段镁带投入稀盐酸中; 4将一小片铝投入稀盐酸中. |
| 实验现象 | A剧烈反应,迅速生成大量的气体 B浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C反应不剧烈,产生无色气体 D有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | B B |
D D |
A A |
C C |
(3)请你补充该小组同学用原子结构理论对上述实验结论的解释:
同周期元素从左到右核电荷数逐渐增多,原子半径逐渐
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[探究一] 实验方案:铝镁合金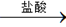 测定生成气体的体积
测定生成气体的体积
实验装置如下图,问题讨论: 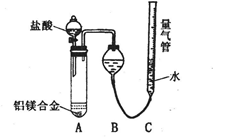
(1)反应完毕,每间隔1分钟读取气体体积,气体体积逐渐减小,直至不变。气体体积减小的原因是
(仪器和实验操作的影响因素除外)。
(2)为使测定结果尽可能精确,实验中应注意的问题除了检查装置的气密性、加入足量盐酸使合金完全溶解和按(1)操作外,请再写出两点:
①
②
(3)如果用分析天平准确称取0.51g镁铝合进行实验,测得生成气体体积为560 mL(已折算成标况下体积),请计算合金中镁的质量分数。(请写出计算过程)___________ ____________________________________________________________________________。
[探究二] 实验方案:称量Bg另一品牌铝镁合金粉末.放在如下图所示装置的惰性电热板上,通电使其充分灼烧。 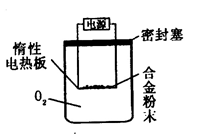
问题讨论:
(1)欲计算Mg的质量分数,该实验中还需测定的数据是 。
(2)用本方案进行实验时,装置中至少要充入O2的物质的量 mol(用含B的最简式表示)。
[实验拓展] 研究小组对某无色透明的溶液进行实验,发现该溶液跟铝反应时放出H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-、NO3-,在下列两种情况下,可能存在于此溶液中的是:
①当与铝反应后生成Al3+时,原溶液可能大量存在的离子 。
②当与铝反应后生成[Al(OH)4]-时,原溶液可能大量存在的离子是 。
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[探究一] 实验方案:铝镁合金 测定生成气体的体积
测定生成气体的体积
实验装置如下图,问题讨论:

(1)反应完毕,每间隔1分钟读取气体体积,气体体积逐渐减小,直至不变。气体体积减小的原因是
(仪器和实验操作的影响因素除外)。
(2)为使测定结果尽可能精确,实验中应注意的问题除了检查装置的气密性、加入足量盐酸使合金完全溶解和按(1)操作外,请再写出两点:
①
②
(3)如果用分析天平准确称取0.51g镁铝合进行实验,测得生成气体体积为560 mL(已折算成标况下体积),请计算合金中镁的质量分数。(请写出计算过程)___________ ____________________________________________________________________________。
[探究二] 实验方案:称量Bg另一品牌铝镁合金粉末.放在如下图所示装置的惰性电热板上,通电使其充分灼烧。
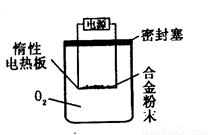
问题讨论:
(1)欲计算Mg的质量分数,该实验中还需测定的数据是 。
(2)用本方案进行实验时,装置中至少要充入O2的物质的量 mol(用含B的最简式表示)。
[实验拓展] 研究小组对某无色透明的溶液进行实验,发现该溶液跟铝反应时放出H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-、NO3-,在下列两种情况下,可能存在于此溶液中的是:
①当与铝反应后生成Al3+时,原溶液可能大量存在的离子 。
②当与铝反应后生成[Al(OH)4]-时,原溶液可能大量存在的离子是 。
查看习题详情和答案>>