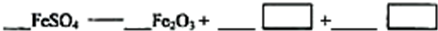摘要:19.工业上硫酸亚铁是生产颜料氧化铁红的原料.其化学方程式为: 2FeSO4 高温==== Fe2O3+SO2↑+SO3↑.为了检验FeSO4高温分解的产物.某研究性学习小组进行了如下实验操作: ⑴ 取少量FeSO4高温分解得到的固体残渣.加一定量稀硝酸溶解.向该溶液中加入适量的KSCN.观察溶液颜色的变化. 甲同学认为根据溶液颜色变成 色.可以证明FeSO4高温分解的产物中有Fe2O3.你认为甲同学的判断正确吗? .理由是 . ⑵乙同学先用下图所示装置检验该反应所产生的气态物质.然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量. 已知:SO2的沸点为-10℃.请回答相关问题: ①A瓶所盛试剂的作用是 ,B瓶所盛的试剂是 ,C瓶所盛试剂的作用是 . ②A瓶要用冷水冷却的原因是 . ③将此反应生成的气体通入A瓶BaCl2溶液中.则 . A.析出BaSO3沉淀 B.析出BaSO4沉淀 C.逸出SO3气体 D.逸出SO2气体
网址:http://m.1010jiajiao.com/timu3_id_167851[举报]
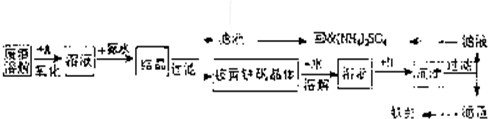
工业上利用硫酸渣(含Fe2-、Fe3-的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如图:
回答下列问题:
(1)在废渣溶解操作时,应选用______溶解(填编号).
A.硫酸 B.盐酸 C.氢氧化化钠 D.氨水
(2)物质A是一种氧化剂,工业上最好选用______(供选择使用的有:H2O2、空气、Cl2、MnO2等),其理由是______.
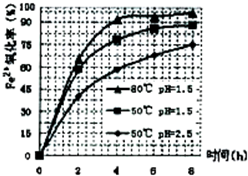
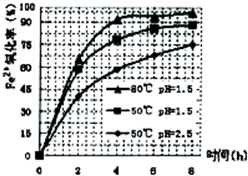
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是______.
(4)往铵黄铁矾(化学式为:(NH4)2Fe6SO4)4(OH)12)溶液中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:______.
(5)若对硫酸渣加强热也可粗制铁红,但产品纯度低而档次低,请写出硫酸渣中硫酸亚铁加强热制备铁红的化学方程式:
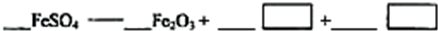
查看习题详情和答案>>
工业上利用硫酸渣(含Fe2-、Fe3-的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如图:

回答下列问题:
(1)在废渣溶解操作时,应选用______溶解(填编号).
A.硫酸 B.盐酸 C.氢氧化化钠 D.氨水
(2)物质A是一种氧化剂,工业上最好选用______(供选择使用的有:H2O2、空气、Cl2、MnO2等),其理由是______.
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是______.

(4)往铵黄铁矾(化学式为:(NH4)2Fe6SO4)4(OH)12)溶液中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:______.
(5)若对硫酸渣加强热也可粗制铁红,但产品纯度低而档次低,请写出硫酸渣中硫酸亚铁加强热制备铁红的化学方程式:

查看习题详情和答案>>

回答下列问题:
(1)在废渣溶解操作时,应选用______溶解(填编号).
A.硫酸 B.盐酸 C.氢氧化化钠 D.氨水
(2)物质A是一种氧化剂,工业上最好选用______(供选择使用的有:H2O2、空气、Cl2、MnO2等),其理由是______.
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是______.

(4)往铵黄铁矾(化学式为:(NH4)2Fe6SO4)4(OH)12)溶液中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:______.
(5)若对硫酸渣加强热也可粗制铁红,但产品纯度低而档次低,请写出硫酸渣中硫酸亚铁加强热制备铁红的化学方程式:

工业上利用硫酸渣(含Fe2-、Fe3-的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如图:

回答下列问题:
(1)在废渣溶解操作时,应选用______溶解(填编号).
A.硫酸 B.盐酸 C.氢氧化化钠 D.氨水
(2)物质A是一种氧化剂,工业上最好选用______(供选择使用的有:H2O2、空气、Cl2、MnO2等),其理由是______.
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是______.

(4)往铵黄铁矾(化学式为:(NH4)2Fe6SO4)4(OH)12)溶液中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:______.
(5)若对硫酸渣加强热也可粗制铁红,但产品纯度低而档次低,请写出硫酸渣中硫酸亚铁加强热制备铁红的化学方程式:

查看习题详情和答案>>

回答下列问题:
(1)在废渣溶解操作时,应选用______溶解(填编号).
A.硫酸 B.盐酸 C.氢氧化化钠 D.氨水
(2)物质A是一种氧化剂,工业上最好选用______(供选择使用的有:H2O2、空气、Cl2、MnO2等),其理由是______.
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是______.

(4)往铵黄铁矾(化学式为:(NH4)2Fe6SO4)4(OH)12)溶液中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:______.
(5)若对硫酸渣加强热也可粗制铁红,但产品纯度低而档次低,请写出硫酸渣中硫酸亚铁加强热制备铁红的化学方程式:

查看习题详情和答案>>
(2010?茂名二模)工业上利用硫酸渣(含Fe2-、Fe3-的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如图:
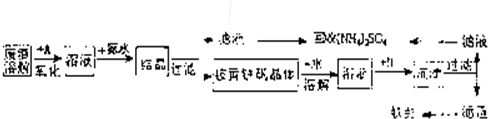
回答下列问题:
(1)在废渣溶解操作时,应选用
A.硫酸 B.盐酸 C.氢氧化化钠 D.氨水
(2)物质A是一种氧化剂,工业上最好选用
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是
(4)往铵黄铁矾(化学式为:(NH4)2Fe6SO4)4(OH)12)溶液中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:
(5)若对硫酸渣加强热也可粗制铁红,但产品纯度低而档次低,请写出硫酸渣中硫酸亚铁加强热制备铁红的化学方程式:
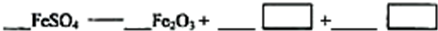
查看习题详情和答案>>

回答下列问题:
(1)在废渣溶解操作时,应选用
A
A
溶解(填编号).A.硫酸 B.盐酸 C.氢氧化化钠 D.氨水
(2)物质A是一种氧化剂,工业上最好选用
空气
空气
(供选择使用的有:H2O2、空气、Cl2、MnO2等),其理由是原料易燃,成本低
原料易燃,成本低
.(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是
溶液温度为80℃,pH为1.5,时间为4小时左右
溶液温度为80℃,pH为1.5,时间为4小时左右
.
(4)往铵黄铁矾(化学式为:(NH4)2Fe6SO4)4(OH)12)溶液中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:
Fe3++3NH3?H2O=Fe(OH)2↓+3NH4+
Fe3++3NH3?H2O=Fe(OH)2↓+3NH4+
.(5)若对硫酸渣加强热也可粗制铁红,但产品纯度低而档次低,请写出硫酸渣中硫酸亚铁加强热制备铁红的化学方程式: