摘要:有Na2CO3 .NaHCO3.NaCl的固体混和物4g.现将它们加热到质量不再减轻.冷却后称得质量为3.38g.在残留固体中加入过量的盐酸产生CO2.该气体经干燥后通过装有足量Na2O2的玻璃管.测得玻璃管中固体的质量增加了0.56g. 求(1)原混和物中NaHCO3的质量, (2)加热后新增加的Na2CO3的质量, (3)残留固体与盐酸反应产生CO2的质量, (4)原混和物中NaCl的质量. 高一化学
网址:http://m.1010jiajiao.com/timu3_id_166815[举报]
(2010?海南)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由下图表示:
请回答下列问题:
(1)A与水反应的化学方程式为
(2)F的化学式为
 和
和
 ;
;
(3)D与H反应可能生成的盐有
(4)实际生产中,可由F为原料制备单质A,简述一种制备方法
查看习题详情和答案>>

请回答下列问题:
(1)A与水反应的化学方程式为
Ca+2H2O═Ca(OH)2+H2↑
Ca+2H2O═Ca(OH)2+H2↑
,E与水反应的化学方程式为NaH+H2O═NaOH+H2↑
NaH+H2O═NaOH+H2↑
;(2)F的化学式为
CaCO3
CaCO3
,G和D的电子式分别为



(3)D与H反应可能生成的盐有
Na2CO3、NaHCO3
Na2CO3、NaHCO3
(填化学式);(4)实际生产中,可由F为原料制备单质A,简述一种制备方法
将CaCO3与盐酸反应生成CaCl2,然后电解熔融的CaCl2固体制取单质钙
将CaCO3与盐酸反应生成CaCl2,然后电解熔融的CaCl2固体制取单质钙
.实验题
(1)某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.1mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
E.用浓度分别为0.50mol/L,体积各为50mL盐酸、氢氧化钠溶液测定中和热
(2)用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol?L -1的氢氧化钠溶液(指示剂为甲基橙)滴定,滴定结果如下:
①根据以上数据可以计算出盐酸的物质的量浓度为
②判断滴定终点的现象是
③以下操作造成测定结果偏高的原因可能是
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用标准液润洗碱式滴定管.
查看习题详情和答案>>
(1)某学生的实验报告所列出的下列数据中合理的是
D
D
.A.用10mL量筒量取7.1mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
E.用浓度分别为0.50mol/L,体积各为50mL盐酸、氢氧化钠溶液测定中和热
(2)用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol?L -1的氢氧化钠溶液(指示剂为甲基橙)滴定,滴定结果如下:
| NaOH起始读数 | NaOH终点读数 | 第一次 | 0.10mL | 18.40mL | 第二次 | 0.30mL | 18.40mL |
0.1456
0.1456
mol?L-1 (小数点后保留两位有效数字).②判断滴定终点的现象是
无色变粉红色且30s不变色
无色变粉红色且30s不变色
③以下操作造成测定结果偏高的原因可能是
ACE
ACE
(填写序号).A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用标准液润洗碱式滴定管.
某无色溶液可能由K2CO3、MgCl2、NaHCO3、BaCl2溶液中的一种或几种组成.向溶液中加入烧碱溶液出现白色沉淀,另取溶液加入稀硫酸也出现白色沉淀并放出气体.据此分析,下列判断中正确的是( )
①肯定有BaCl2; ②肯定有MgCl2; ③肯定有NaHCO3; ④肯定有Na2CO3或NaHCO3; ⑤肯定没有MgCl2.
①肯定有BaCl2; ②肯定有MgCl2; ③肯定有NaHCO3; ④肯定有Na2CO3或NaHCO3; ⑤肯定没有MgCl2.
查看习题详情和答案>>
(2010?朝阳区一模)工业上以氨气为原料制备硝酸的过程如图1所示:
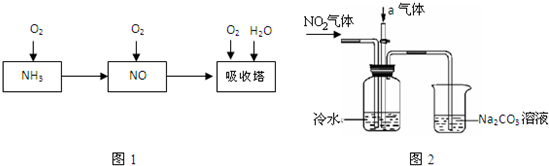
某课外小组模拟上述部分过程设计了如图2所示实验装置制备硝酸(所有橡胶制品均已被保护).
(1)工业上用氨气制取NO的化学方程式是
(2)连接好装置后,首先进行的操作是
(3)通入a气体的目的是
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是2NO2+Na2CO3═NaNO2+
(5)已知:温度低于21.15℃时,NO2几乎全部转变为N2O2.工业上可用N2O4与水反应来提高硝酸产率.N2O4与a气体在冷水中生成硝酸的化学方程式是
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L.则2NO2(g)?N2O4(g)的平衡常数K=
.若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为
查看习题详情和答案>>

某课外小组模拟上述部分过程设计了如图2所示实验装置制备硝酸(所有橡胶制品均已被保护).
(1)工业上用氨气制取NO的化学方程式是
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(2)连接好装置后,首先进行的操作是
检验装置的气密性
检验装置的气密性
.(3)通入a气体的目的是
提高NO2的转化率
提高NO2的转化率
.(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是2NO2+Na2CO3═NaNO2+
NaNO3
NaNO3
+CO2
CO2
(5)已知:温度低于21.15℃时,NO2几乎全部转变为N2O2.工业上可用N2O4与水反应来提高硝酸产率.N2O4与a气体在冷水中生成硝酸的化学方程式是
2N2O4+O2+2H2O=4HNO3
2N2O4+O2+2H2O=4HNO3
.(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L.则2NO2(g)?N2O4(g)的平衡常数K=
| 1 |
| 2 |
| 1 |
| 2 |
50%
50%
.