摘要:21.(1)H-H的键能为436kJ/mol.它所表示的意义是形成1molH-H键所 ▲ 的最低能量为436kJ.反之如果要使1molH-H键断裂则 ▲ 能量. (2)白磷P4(图1)是正四面体构型的分子.当与氧气作用时.每两个磷原子之间插入一个氧原子.此外每个磷原子又以双键再结合一个氧原子形成P4O10(图3).如图: 图1(P4) 图2(P4O6) 图3(P4O10) 化学反应本质是旧键断裂和新键的形成. 现提供以下化学键的键能:P-P键:198 kJ/mol,P-O键:360 kJ/mol, O=O键:498 kJ/mol,P=O键:585 kJ/mol, 试根据这些数据.通过计算.判断反应:P4+5O2=P4O10是吸热反应还是放热反应.吸收或者放出热量的值是多少?
网址:http://m.1010jiajiao.com/timu3_id_166586[举报]
如图是工业生产硝酸的流程.
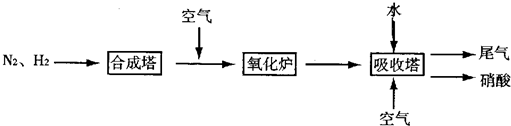
合成塔中内置铁触媒,氧化炉中内置Pt-Rh合金.请回答下列问题:
(1)1909年化学家哈伯在实验室首次合成了氨.2007年格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:

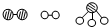 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别为 , .
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别为 , .
(2)已知N≡N的键能是946kJ?mol-1,H-H的键能为436kJ?mol-1,N-H的键能为393kJ?mol-1,写出合成塔中发生反应的热化学方程式 .
(3)已知4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ?mol-1;
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.8kJ?mol-1;
则热化学方程式N2(g)+O2(g)═2NO(g)△H= kJ?mol-1.
(4)吸收塔中通入空气的目的是 .
查看习题详情和答案>>

合成塔中内置铁触媒,氧化炉中内置Pt-Rh合金.请回答下列问题:
(1)1909年化学家哈伯在实验室首次合成了氨.2007年格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:

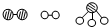 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别为
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别为(2)已知N≡N的键能是946kJ?mol-1,H-H的键能为436kJ?mol-1,N-H的键能为393kJ?mol-1,写出合成塔中发生反应的热化学方程式
(3)已知4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ?mol-1;
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.8kJ?mol-1;
则热化学方程式N2(g)+O2(g)═2NO(g)△H=
(4)吸收塔中通入空气的目的是
现已知:2H2(g)+O2(g)=2H2O(l),△H=-572kJ/mol;H-H键的键能为436kJ/mol;O=O 键的键能为498kJ/mol,则H2O分子中O-H键的键能为( )
查看习题详情和答案>>
 (1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应.
(1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应.已知:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ?mol-1,
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ?mol-1.
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式:
2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7kJ?mol-1
2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7kJ?mol-1
.(2)已知:N≡N的键能是946kJ?mol-1,H-H的键能为436kJ?mol-1,N-H的键能为393kJ?mol-1,计算合成氨反应生成1molNH3的△H=
-52
-52
kJ?mol-1.(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为
0.05mol/L
0.05mol/L
②加水稀释100倍,所得溶液中由水电离出c(OH-)=
1×10-11mol/L
1×10-11mol/L
③与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11,该盐酸溶液的pH=
2
2
.(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈
碱性
碱性
(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+)>
>
c(CH3COO-)(填“>”或“=”或“<”).②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈
酸性
酸性
,溶液中c(Na+)<
<
c(CH3COO-).③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈
中性
中性
,醋酸体积>
>
氢氧化钠溶液体积.