摘要:第四单元复习 复习要求:1.准确认读识字4.5.6三课的生字.较熟练的掌握“虫.田.天.牛.沙.贝.风.浪.渔泉.乐.厅.林.阴.车.交 这些生字的音形义.能按笔顺正确.端正.整洁的书写.进一步掌握笔画“提.竖提.横撇弯勾 .
网址:http://m.1010jiajiao.com/timu3_id_166059[举报]
某教师在上《元素周期表》复习课时,组织了一个“介绍自己”的活动: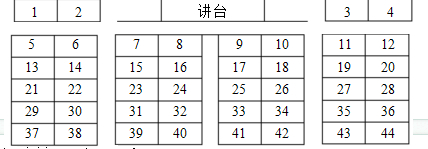
我们班级中共有44位同学,分为8个小组,按从左到右分别为IA、IIA…VIIA、0族,从上到下分别为第一、二…六周期.座位上的每一位同学对应一种元素,请在下列问题中符合要求的同学向大家介绍自己.
请你一起思考并回答下列问题:
(1)第三周期IVA族的元素对应座位号是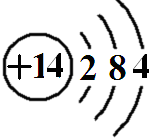
 .
.
(2)座位号为22的元素在元素周期表中的位置是
(3)比较座位号为18、19对应的元素的非金属性强弱,请用离子方程式表示
(4)课堂中有学生提出,这样的安排会导致他们没有对应的元素,则学生对应的座位号是
查看习题详情和答案>>

我们班级中共有44位同学,分为8个小组,按从左到右分别为IA、IIA…VIIA、0族,从上到下分别为第一、二…六周期.座位上的每一位同学对应一种元素,请在下列问题中符合要求的同学向大家介绍自己.
请你一起思考并回答下列问题:
(1)第三周期IVA族的元素对应座位号是
16
16
,原子结构示意图为

(2)座位号为22的元素在元素周期表中的位置是
第四周期第IIA族
第四周期第IIA族
.(3)比较座位号为18、19对应的元素的非金属性强弱,请用离子方程式表示
Cl2+S2-=S↓+2Cl-或Cl2+H2S=2H++S↓+2Cl-
Cl2+S2-=S↓+2Cl-或Cl2+H2S=2H++S↓+2Cl-
.(4)课堂中有学生提出,这样的安排会导致他们没有对应的元素,则学生对应的座位号是
2,3
2,3
.(2011?西安模拟)[化学一选修物质结构与性质]
A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液.a、b能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列1-3问:
(1)C和D的离子中,半径较小的是
(2)实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多,其原因是
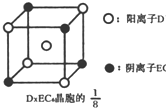
(3)C、D、E可组成离子化合物DxE6其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用0表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:
Mn元素价电子层的电子排布式为
(5)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中c原子的杂化轨遣类型是
写出一种与CN-互为等电子体的单质分子的路易斯结构式
查看习题详情和答案>>
A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液.a、b能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列1-3问:
(1)C和D的离子中,半径较小的是
Na+
Na+
(填离子符号).(2)实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多,其原因是
由于HF中含有氢键相结合的聚合氟化氢分子(HF)n
由于HF中含有氢键相结合的聚合氟化氢分子(HF)n
.(3)C、D、E可组成离子化合物DxE6其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用0表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用
 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是Na3AlF6
Na3AlF6
.
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| 电离 能/kJ?mol-1 |
Ⅰ1 | 717 | 759 |
| Ⅱ2 | 1509 | 1561 | |
| Ⅲ3 | 3248 | 2957 |
Mn元素价电子层的电子排布式为
3d54s2
3d54s2
,比较两元素的I2J3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少
由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少
;(5)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
具有弧对电子
具有弧对电子
.②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中c原子的杂化轨遣类型是
sp
sp
;写出一种与CN-互为等电子体的单质分子的路易斯结构式
N≡N
N≡N
. [化学-选修物质结构与性质]现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元(图形以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同,单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相同的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.
[化学-选修物质结构与性质]现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元(图形以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同,单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相同的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式①
(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电离能由大到小的顺序
(3)F分子的空间构型是①
(4)C分子的中心原子杂化类型是
学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣.是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究.请你根据要求完成下列部分实验报告.
Ⅰ课题名称:
Ⅱ实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、大试管、酒精灯、计时器等.
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
Ⅲ实验步骤:略
Ⅳ实验数据:
Ⅴ实验讨论:
(1)实验编号1的实验作用是
(2)实验编号3的实验中KClO3的分解率为
(3)在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色.该刺激性气体可能是
Ⅵ实验结论:
查看习题详情和答案>>
Ⅰ课题名称:
探究二氧化锰、氧化铁、氧化铜、氧化铬的氧化能力的比较
探究二氧化锰、氧化铁、氧化铜、氧化铬的氧化能力的比较
Ⅱ实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、大试管、酒精灯、计时器等.
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
Ⅲ实验步骤:略
Ⅳ实验数据:
|
实验 编号 |
KClO3(g) | 氧化物 |
产生气体(mL) (已折算到标况) |
耗时(s) | ||
| 化学式 | 质量(g) | 回收 | ||||
| 1 | 0.60 | - | - | - | 10 | 480 |
| 2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
(1)实验编号1的实验作用是
对照实验
对照实验
.(2)实验编号3的实验中KClO3的分解率为
40.8
40.8
%(保留一位小数)(3)在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色.该刺激性气体可能是
Cl2
Cl2
(填分子式),可用湿润的淀粉碘化钾
湿润的淀粉碘化钾
试纸检验.上述异常现象产生的原因是KClO3与Cr2O3发生了氧化还原反应
KClO3与Cr2O3发生了氧化还原反应
.Ⅵ实验结论:
氧化铁和二氧化锰的催化能力较好
氧化铁和二氧化锰的催化能力较好
. 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题:
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题:(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式
SiO2+2C
Si+2CO↑
| ||
SiO2+2C
Si+2CO↑
;同主族的第四周期元素基态原子的外围电子排布式为
| ||
4s24p2
4s24p2
.(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电离能由大到小的顺序:
N>O>C
N>O>C
.(3)上述六种物质或粒子中互为等电子体的是
CH4、NH4+
CH4、NH4+
(写出化学式).(4)F分子的中心原子杂化类型是
sp3杂化
sp3杂化
,F易溶于E,其原因是NH3和H2O为极性分子符合相似相溶原理,且NH3和H2O分子之间能形成氢键
NH3和H2O为极性分子符合相似相溶原理,且NH3和H2O分子之间能形成氢键
.