网址:http://m.1010jiajiao.com/timu3_id_165076[举报]
“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为 :
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ?mol-1
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ?mol-1
C.2H2(g) + O2(g) = 2H2O(l); △H =-571.6kJ?mol-1
D.H2(g) + 1/2O2(g) = H2O(g); △H = -285.8kJ?mol-1
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤:
①CaBr2+H2O![]() CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg ![]() HgBr2+H2
HgBr2+H2
③HgBr2+CaO ![]() HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO ![]() 2Hg+O2↑
2Hg+O2↑
你认为该方法的主要缺点是 。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘,。
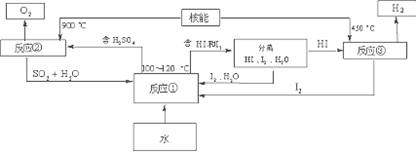
请写出反应①的化学方程式: ;
该法制取氢气最大的优点是: ;
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实? (填“不现实”或“现实”),说明能够支持你的观点的两点理由:, ;
。
查看习题详情和答案>>(1)实验测得,1克氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为______
A.2H2(g)+O2(g)=2H2O(l);△H=-142.9kJ/mol
B.H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol
C.2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
D.H2(g)+1/2O2(g)=H2O(g);△H=-285.8kJ/mol
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
①CaBr2+H2O
| ||
| ||
③HgBr2+CaO
| ||
| ||
上述过程的总反应可表示为______.
(3)利用核能把水分解,制出氢气,是目前许多国家正在研究的课题.下图是国外正在研究中的一种流程(硫-碘热循环法),其中用了过量的碘.
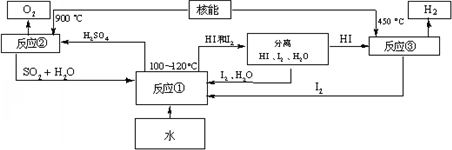
请写出反应①的化学方程式:______.
用硫-碘热循环法制取氢最大的优点是______.
(4)也有人认为利用氢气作为能源不太现实.你的观点呢?请说明能够支持你的观点的两点理由______.
(1)试分析为什么“氢能”将是21世纪最理想的新能源。
(2)目前世界上的氢能绝大部分是通过石油、煤炭和天然气制取的,如用水蒸气和炽热的炭反应生成氢气。请写出由天然气制取氢气的化学方程式,并分析该方法是否是理想的长久方法。
(3)已知HI不稳定,易分解。利用硫-碘热循环法制取氢气也是化学家常用的一种方法,总化学方程式为:
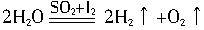 ,其循环过程分三步进行:
,其循环过程分三步进行:①SO2+I2+H2O→A+B
②A→?+H2
③B→?+?+?
A.完成以上三步反应,并确定哪步反应最难进行。
B.请对硫-碘热循环法制取氢气的优劣和前景做出分析。
(4)列举两种简单安全地输送氢气的方法。 查看习题详情和答案>>
(1)实验测得,1克氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为______
A.2H2(g)+O2(g)=2H2O(l);△H=-142.9kJ/mol
B.H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol
C.2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
D.H2(g)+1/2O2(g)=H2O(g);△H=-285.8kJ/mol
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
①CaBr2+H2O
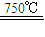 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg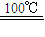 HgBr2+H2↑
HgBr2+H2↑③HgBr2+CaO
 HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO 2Hg+O2↑
2Hg+O2↑上述过程的总反应可表示为______.
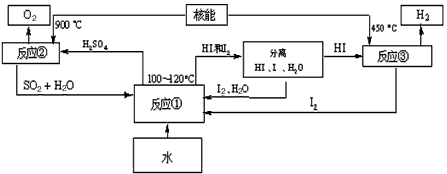
(3)利用核能把水分解,制出氢气,是目前许多国家正在研究的课题.下图是国外正在研究中的一种流程(硫-碘热循环法),其中用了过量的碘.

请写出反应①的化学方程式:______.
用硫-碘热循环法制取氢最大的优点是______.
(4)也有人认为利用氢气作为能源不太现实.你的观点呢?请说明能够支持你的观点的两点理由______.
查看习题详情和答案>>
 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg HgBr2+H2↑ ③HgBr2+CaO
HgBr2+H2↑ ③HgBr2+CaO HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO 2Hg+O2↑ 上述过程的总反应可表示为__________________________。
2Hg+O2↑ 上述过程的总反应可表示为__________________________。