摘要:酸性 2.氧化性 3.漂白性
网址:http://m.1010jiajiao.com/timu3_id_164261[举报]
漂白粉是日常生活中最常用一种漂白剂和消毒剂.
(1)写出工业上用氯气与熟石灰反应制取漂白粉的化学方程式:
(2)漂白粉在酸性条件下可增强漂白效果.写出漂白粉与稀盐酸反应的化学方程式:
(3)漂白粉需要密封避光保存于阴凉处的原因是:
查看习题详情和答案>>
(1)写出工业上用氯气与熟石灰反应制取漂白粉的化学方程式:
2Cl2 +2Ca(OH)2=Ca(ClO)2 +CaCl2 +2H2O
2Cl2 +2Ca(OH)2=Ca(ClO)2 +CaCl2 +2H2O
.此反应中氧化剂是Cl2
Cl2
,1mol氯气完全反应转移电子的物质的量是1mol
1mol
.发生氧化反应的物质是Cl2
Cl2
,(2)漂白粉在酸性条件下可增强漂白效果.写出漂白粉与稀盐酸反应的化学方程式:
Ca(ClO)2 +2HCl=2HClO+CaCl2
Ca(ClO)2 +2HCl=2HClO+CaCl2
.(3)漂白粉需要密封避光保存于阴凉处的原因是:
Ca(ClO)2能和空气中CO2、H2O发生反应,以及反应生成的HClO光照或受热会发生分解
Ca(ClO)2能和空气中CO2、H2O发生反应,以及反应生成的HClO光照或受热会发生分解
.漂白粉是一种常用杀菌、消毒剂,其有效成分为次氯酸钙.下图为制取漂白粉的工业流程简图.
| 信息卡 常温下碳酸钙难溶于水,氢氧化钙微溶于水,氯化钙易溶于水.次氯酸钙易溶于水,酸性条件下不稳定、100°C时发生分解反应. 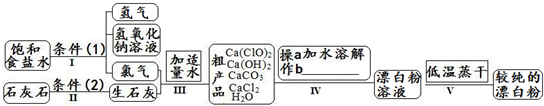 (1)流程I 得到浓度为80g?L-1氢氧化钠溶液,其物质的量浓度是 2 2 mol?L-1.(2)写出流程I发生反应的化学反应方程式,并用双线桥表示其电子转移的方向和数目:   高温 高温 .(3)流程III中发生两个反应,写出其中的氧化还原反应的化学反应方程 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O .其中氧化剂是Cl2 Cl2 ;还原剂是Cl2 Cl2 .(写化学式)(4)流程IV中操作b是: 过滤 过滤 .(写名称)(5)流程V进行低温蒸干的原因是: Ca(ClO)2在100°C时发生分解反应 Ca(ClO)2在100°C时发生分解反应 .(6)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因 Ca(ClO)2+CO2+H2O═CaCO3+2HClO Ca(ClO)2+CO2+H2O═CaCO3+2HClO .(7)氯水和次氯酸钙都能起漂白、消毒作用.是因为它们都能产生同一种物质,写出氯气与水反应产生该物质的化学方程式 Cl2+H2O  HCl+HClO HCl+HClOCl2+H2O . HCl+HClO HCl+HClO(8)在酸性条件下次氯酸钙的氧化性比氯气强,能将溴离子氧化成溴单质,而次氯酸钙中的氯元素则被还原为负一价的氯离子,氧元素则转化为水.试写出次氯酸钙和稀盐酸的混合物与溴化钠反应的化学方程式: Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O .
查看习题详情和答案>>
漂白粉是日常生活中的一种常用消毒剂、杀菌剂和漂白剂.请根据要求回答问题:
(1)漂白粉的有效成分是次氯酸钙[Ca(ClO)2],将氯气通入熟石灰(含水的质量分数略小于1%)即可制取,该反应的化学方程式为 (2)漂白粉具有漂白作用是因为Ca(ClO)2水解生成了次氯酸(HClO),写出该水解反应的离子方程式 (3)Ca(ClO)2溶液中各离子浓度由大到小的顺序是 (4)空气中的二氧化碳可以可增强漂白粉的漂白效果,用化学方程式表示其原理 (5)漂白粉与洁厕剂等强酸性物质混合使用可生成一种有毒气体,写出该反应的离子方程式
漂白粉是一种常用杀菌、消毒剂,其有效成分为次氯酸钙.下图为制取漂白粉的工业流程简图.
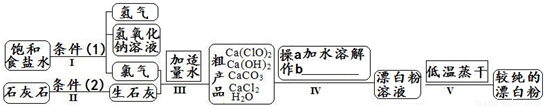 (1)流程I 得到浓度为80g?L-1氢氧化钠溶液,其物质的量浓度是______ mol?L-1. (2)写出流程I发生反应的化学反应方程式,并用双线桥表示其电子转移的方向和数目:______.流程II的反应条件(2)是______. (3)流程III中发生两个反应,写出其中的氧化还原反应的化学反应方程______.其中氧化剂是______;还原剂是______.(写化学式) (4)流程IV中操作b是:______.(写名称) (5)流程V进行低温蒸干的原因是:______. (6)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因______. (7)氯水和次氯酸钙都能起漂白、消毒作用.是因为它们都能产生同一种物质,写出氯气与水反应产生该物质的化学方程式______. (8)在酸性条件下次氯酸钙的氧化性比氯气强,能将溴离子氧化成溴单质,而次氯酸钙中的氯元素则被还原为负一价的氯离子,氧元素则转化为水.试写出次氯酸钙和稀盐酸的混合物与溴化钠反应的化学方程式:______. 查看习题详情和答案>> 过氧化氢俗名双氧水,分子中含有氧氧非极性共价键,医疗上可作外科消毒剂.试回答下列问题:
查看习题详情和答案>>
(1)H2O2的电子式是   1s22s22p4 1s22s22p4 .(2)将双氧水加入经酸化的KMnO4溶液中,溶液的紫红色消褪了,此时双氧水表现出 还原 还原 性.(3)实验室用双氧水制取氧气时常加入二氧化锰,该反应的化学方程式为 2H2O2
2H2O2 .
(4)过氧化氢具有漂白性.某学生研究了过氧化钠跟水的反应,实验过程如下:向盛有少量过氧化钠固体的试管中滴加水,直到气体不再放出,再加水稀释所得溶液.将得到的溶液平均分成两份盛放在两支试管中,进行下列实验: 实验一:一支试管中滴加酚酞试液,溶液变红,半分钟内红色褪去; 实验二:另一支试管中加入少量二氧化锰,又有气体放出,待气体不再放出,再滴加酚酞,溶液变红,持久不褪色.请回答下列问题: ①实验一酚酞变红后,半分钟内红色又褪去,原因 生成了H2O2,生成的双氧水具有强氧化性和漂白性,把红色氧化成无色溶液而褪色 生成了H2O2,生成的双氧水具有强氧化性和漂白性,把红色氧化成无色溶液而褪色 .②H2O2常被称作“绿色氧化剂”的原因是 产物是水,不可能引起污染 产物是水,不可能引起污染 .③我们知道,稀硫酸与铜不反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的离子方程式 Cu+H2O2+2H+=Cu2++2H2O Cu+H2O2+2H+=Cu2++2H2O . |