摘要: 实验室有下列试剂:NaHSO4.MnO2.KCl.Na2O2.H2O.Zn,欲制取HCl.Cl2.O2.H2.其中不合理的组合是 A.制Cl2:MnO2.KCl B.制HCl:NaHSO4.KCl C.制O2:H2O.Na2O2 D.制H2:NaHSO4.H2O.Zn 第Ⅱ卷(非选择题 共3道简答题2道实验题2道计算题 请将你认为正确的答案代号填在下表中 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
网址:http://m.1010jiajiao.com/timu3_id_164164[举报]
(2009?清远模拟)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
查阅资料
Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
×100%
×100%.
(5)实验小组欲利用该红色粉末制取较纯净的胆矶 (CuSO4.5H2O).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
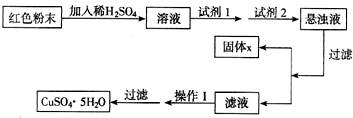
试回答:
试剂1为
查看习题详情和答案>>
查阅资料
Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
没有红色不溶物,滴加KSCN溶液,溶液变为红色
没有红色不溶物,滴加KSCN溶液,溶液变为红色
.(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
不合理
不合理
.简述你的理由(可不写反应的方程式 )Cu能将Fe3+还原为Fe2+
Cu能将Fe3+还原为Fe2+
.(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
Fe2O3和Cu2O的混合物
Fe2O3和Cu2O的混合物
,写出发生反应的离子方程式Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+
Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+
.探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
| 9(b-a) |
| a |
| 9(b-a) |
| a |
(5)实验小组欲利用该红色粉末制取较纯净的胆矶 (CuSO4.5H2O).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验小组设计如下实验方案:

试回答:
试剂1为
B
B
,试剂2为D
D
(填字母序号);固体x的化学式是Fe(OH)3
Fe(OH)3
.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
×100%
×100%.
(5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04.5H20).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
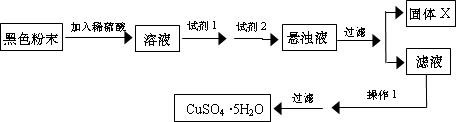
试回答:
①试剂I为
②固体X的化学式为
③操作I为
查看习题详情和答案>>
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
溶液变为血红色
溶液变为血红色
.(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
不合理
不合理
简述你的理由(不需写出反应的方程式 )Cu能将Fe3+还原为Fe2+
Cu能将Fe3+还原为Fe2+
.(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
Fe2O3和Cu2O的混合物
Fe2O3和Cu2O的混合物
,写出发生反应的离子方程式Fe2O3+6H+=2Fe3++3H2O;Cu2O+2H+=Cu+Cu2++H2O;2Fe3++Cu=2Fe2++Cu2+
Fe2O3+6H+=2Fe3++3H2O;Cu2O+2H+=Cu+Cu2++H2O;2Fe3++Cu=2Fe2++Cu2+
.探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
| 9(b-a) |
| a |
| 9(b-a) |
| a |
(5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04.5H20).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验小组设计如下实验方案:

试回答:
①试剂I为
B
B
,试剂II为D
D
(填字母).②固体X的化学式为
Fe(OH)3
Fe(OH)3
.③操作I为
加热蒸发
加热蒸发
.(2009?大连一模)细菌冶金是一种新工艺,其能耗少、减少环境污染.称为“绿色冶金”.其原理:①氧化硫硫杆菌和聚硫杆菌能把矿石中的硫氧化成硫酸,反应式为2S+3O2+2H2O═2H2SO4,②氧化亚铁硫杆菌在上面产生的硫酸中能把硫酸亚铁氧化成硫酸铁③细菌得到了所需要的能量,生成的硫酸铁可把FeS2(黄铁矿)和Cu2S(辉铜矿)等转变为可溶性化合物而从矿石中溶解出来,其化学过程是:
Fe2S2(黄铁矿)+7Fe2(SO4)3+8H2O═15FeSO4+8H2SO4
Cu2S(辉铜矿)+2Fe2(SO4)2═2CuSO4+4FeSO4+S
(1)写出②反应的化学方程式:
(2)某实验小组,欲将硫酸铜和硫酸亚铁的酸性混合液分离出硫酸亚铁溶液.经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如表2
实验室有下列试剂可供选择A. H2O2 B.CaO C.CuO D.稀H2SO4 E.铁粉;
实验经过滤后还需设计的实验操作步骤和目的是:
(3)若向CuSO4、FeSO4混合液中加入适量碱液,将溶液蒸干、灼烧得到红色粉末是Fe2O3、Cu2O混合物,欲测定该混合物中Cu2O的质量分数.该实验小组的方法是向m g混合物中加入足量的稀硫酸,经过滤、洗涤、干燥、称量固体的质量为n g.已知Cu2O溶于稀硫酸生成Cu和CuSO4.某学生据此计算出该混合物Cu2O的质量分数的计算式
×100%.该学生的计算是否正确:
查看习题详情和答案>>
Fe2S2(黄铁矿)+7Fe2(SO4)3+8H2O═15FeSO4+8H2SO4
Cu2S(辉铜矿)+2Fe2(SO4)2═2CuSO4+4FeSO4+S
(1)写出②反应的化学方程式:
4FeSO4+2H2SO4+O2
2Fe2(SO4)3+2H2O
| ||
4FeSO4+2H2SO4+O2
2Fe2(SO4)3+2H2O
.
| ||
(2)某实验小组,欲将硫酸铜和硫酸亚铁的酸性混合液分离出硫酸亚铁溶液.经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如表2
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验经过滤后还需设计的实验操作步骤和目的是:
| 实验步骤 | 实验操作 | 实验操作的目的 |
| 步骤1 | 加入H2O2 加入H2O2 |
把二价铁氧化成三价 把二价铁氧化成三价 |
| 步骤2 | 加入适量氧化铜,调节pH到3.7 加入适量氧化铜,调节pH到3.7 |
保证三价铁完全沉淀 保证三价铁完全沉淀 |
| 步骤3 | 过滤 过滤 |
滤出氢氧化铁 滤出氢氧化铁 |
| 步骤4 | 洗涤 | 除去杂质 除去杂质 |
| 步骤5 | 向沉淀中加入适量稀硫酸和适量铁粉 向沉淀中加入适量稀硫酸和适量铁粉 |
得到FeSO4溶液 |
| 144n |
| 64m |
不正确
不正确
,请说明理由因为该计算没有考虑Cu与Fe3+的反应
因为该计算没有考虑Cu与Fe3+的反应
.
Ⅰ.现在四种化学仪器:A.量筒 B.容量瓶 C.滴定管 D.烧杯
(1)标有“0”刻度的化学仪器为 ;(填代号,下同)
(2)实验时,要用所装液体润洗的是 ;
(3)使用前要检验是否漏水的仪器 ;
(4)量取液体体积时,平视时读数为n mL,仰视时读数为x mL,俯视时读数为y mL,若x<n<y,则所用的仪器为 .
Ⅱ.某实验小组欲从硫酸铜和硫酸亚铁的酸性混合溶液中分离出硫酸亚铁溶液,经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH值如下表:
实验室有下列试剂可供选择:H2O2、CaO、CuO、稀H2SO4、铁粉
(1)分离实验的实验操作步骤和目的为:
(2)步骤4中需要的玻璃仪器为 、 、 ;检验沉淀洗涤干净的操作方法为 .
查看习题详情和答案>>
(1)标有“0”刻度的化学仪器为
(2)实验时,要用所装液体润洗的是
(3)使用前要检验是否漏水的仪器
(4)量取液体体积时,平视时读数为n mL,仰视时读数为x mL,俯视时读数为y mL,若x<n<y,则所用的仪器为
Ⅱ.某实验小组欲从硫酸铜和硫酸亚铁的酸性混合溶液中分离出硫酸亚铁溶液,经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH值如下表:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
(1)分离实验的实验操作步骤和目的为:
| 实验步骤 | 实验操作 | 实验操作目的 |
| 步骤1 | ||
| 步骤2 | ||
| 步骤3 | ||
| 步骤4 | 洗涤沉淀 | |
| 步骤5 | 得到FeSO4溶液 |
