摘要:12.3mol Cu和含7mol H2SO4的浓硫酸共热.充分反应后.未被还原的H2SO4的物质的量为 ( ) A.3 mol B.4 mol C.小于4 mol D.大于4 mol
网址:http://m.1010jiajiao.com/timu3_id_164043[举报]
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如图:
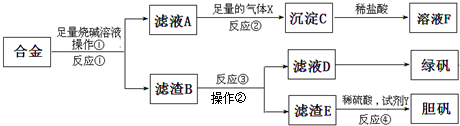
请回答:
(1)绿矾的化学式为 .
(2)写出反应①的化学方程式 ,反应②生成沉淀的离子反应方程式 .
(3)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选): .
(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是 .
(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色液体,则反应④的总化学方程式为 ;若不考虑绿色化学工艺,所选试剂Y为1mol/L的硝酸,欲使3mol Cu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积 L.
查看习题详情和答案>>

请回答:
(1)绿矾的化学式为
(2)写出反应①的化学方程式
(3)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选):
(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是
(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色液体,则反应④的总化学方程式为
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)
(1)硝酸在该反应中的作用是
(2)0.3mol Cu被硝酸完全溶解后,Cu失去的电子数是
(3)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式
(4)如果没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组.原因是
查看习题详情和答案>>
(1)硝酸在该反应中的作用是
氧化剂、酸
氧化剂、酸
,该反应的还原产物是NO、NO2
NO、NO2
.(2)0.3mol Cu被硝酸完全溶解后,Cu失去的电子数是
0.6NA
0.6NA
个,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是0.9mol
0.9mol
,若用排水法收集这些气体,可得标准状况下的气体体积4.48L
4.48L
.(3)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式
3Cu+10H++4NO3-→3Cu2++NO↑+3NO2↑+5H2O
3Cu+10H++4NO3-→3Cu2++NO↑+3NO2↑+5H2O
.(4)如果没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组.原因是
该反应式含两种还原产物,两者的比例和氧化剂、还原剂的用量都可以发生变化
该反应式含两种还原产物,两者的比例和氧化剂、还原剂的用量都可以发生变化
.