摘要:18.用加热的方法可分离下列物质的是 ( ) A.碘和食盐 B.氯化铵和氯化钡 C.氯化铵和消石灰 D.碳铵和过氧化钠
网址:http://m.1010jiajiao.com/timu3_id_164023[举报]
A.学习化学离不开化学实验,通过实验会使你认识化学,打开化学之门。请回答下列问题:
(1)某学生设计用如下实验方案用以检验淀粉水解的情况:
(1)某学生设计用如下实验方案用以检验淀粉水解的情况:

由水解液加碘水后发生的现象,可得出的实验结论应该是 (填序号)。
A.淀粉尚有部分未水解 B.淀粉已完全水解 C.淀粉没有水解
(2)取透明三角板、牙刷柄等废弃聚苯乙烯塑料制品碎片20~30 g,放入圆底烧瓶中,加入10 g碎玻璃渣和适量A12O3或无水A1C13并混合均匀。按下图安装好实验装置。B瓶收集液态产物,试管C中盛放稀的酸性高锰酸钾溶液或溴水。加热烧瓶,观察发生的现象。
A.淀粉尚有部分未水解 B.淀粉已完全水解 C.淀粉没有水解
(2)取透明三角板、牙刷柄等废弃聚苯乙烯塑料制品碎片20~30 g,放入圆底烧瓶中,加入10 g碎玻璃渣和适量A12O3或无水A1C13并混合均匀。按下图安装好实验装置。B瓶收集液态产物,试管C中盛放稀的酸性高锰酸钾溶液或溴水。加热烧瓶,观察发生的现象。

请回答下列问题:
①实验中加入A12O3或无水A1C13的作用是 ;
②B瓶收集液态产物是 ;
B.金属具有良好的导电、导热及延展性等,因此广泛应用于制造各种材料。请回答下列问题:
(1)家庭中“钢精锅”是由铝合金做成的,它能否长期存放食盐水? 。(填能或否)
(2)下列关于铁制品保护措施的说法中不正确的有 (填序号)。
①在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油
②相同条件下,马口铁(表层镀锡)与白铁(表层镀锌)相比,马口铁更为耐用
③在海轮的外壳上常焊有锌块,且定期更新
④将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理
①实验中加入A12O3或无水A1C13的作用是 ;
②B瓶收集液态产物是 ;
B.金属具有良好的导电、导热及延展性等,因此广泛应用于制造各种材料。请回答下列问题:
(1)家庭中“钢精锅”是由铝合金做成的,它能否长期存放食盐水? 。(填能或否)
(2)下列关于铁制品保护措施的说法中不正确的有 (填序号)。
①在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油
②相同条件下,马口铁(表层镀锡)与白铁(表层镀锌)相比,马口铁更为耐用
③在海轮的外壳上常焊有锌块,且定期更新
④将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理
C.邻羟基苯甲酸的结构式为 ,俗名为水杨酸,在医学上具有 作用
,俗名为水杨酸,在医学上具有 作用
D.保持洁净安全的生存环境已成为全人类的共识。
(1)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量。为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行 。
(2)人类产生的垃圾应进行分类回收、集中处理,即便如此,仍会剩余不少垃圾,因此必须对剩余垃圾进一步处理,除卫生填埋外,还有一种能够改变垃圾的组成、结构使其体积减小、充分利用其所具有的能量并使之无害化的处理方式,这种垃圾的处理方式是 技术。
查看习题详情和答案>>
 ,俗名为水杨酸,在医学上具有 作用
,俗名为水杨酸,在医学上具有 作用 D.保持洁净安全的生存环境已成为全人类的共识。
(1)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量。为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行 。
(2)人类产生的垃圾应进行分类回收、集中处理,即便如此,仍会剩余不少垃圾,因此必须对剩余垃圾进一步处理,除卫生填埋外,还有一种能够改变垃圾的组成、结构使其体积减小、充分利用其所具有的能量并使之无害化的处理方式,这种垃圾的处理方式是 技术。
(1)有下列操作供选择:
A.加NaOH溶液 B.加盐酸 C.加硝酸 D.加热 E.加AgNO3溶液 F.加水过滤 G.加MnO2 H.置于空气中(填序号,可以重复选择)
证明一种金属粉末是铁粉的操作顺序是____________。
证明KClO3中含有氯元素的操作顺序是____________。
(2)亚硝酸钠NaNO2可用作水泥施工的抗冻剂。它易溶于水,有碱味,有氧化性,也有还原性。在酸性溶液中它能氧化碘离子、亚铁离子。它能将人体内血红蛋白里所含有亚铁离子氧化为三价铁离子使人中毒,在建筑工地上多次发生把硝酸钠误作食盐使用,导致民工中毒的事件。亚硝酸钠和酸反应应生产亚硝酸,亚硝酸是不稳定的弱酸,它只存于冷的稀溶液中,易发生如下分解反应。3HNO2=2NO↑+HNO3+
H2O从醋酸、氨水、纯碱、稀盐酸、碘化钾淀粉溶液中选择适当的物质做试剂,用两种简单的化学实验方法来鉴别亚硝酸钠和氯化钠。
方法一:试剂是(只用一种试剂)____________;现象:____________。
方法二:实验步骤及实验现象是__________________________________。
查看习题详情和答案>>
A.加NaOH溶液 B.加盐酸 C.加硝酸 D.加热 E.加AgNO3溶液 F.加水过滤 G.加MnO2 H.置于空气中(填序号,可以重复选择)
证明一种金属粉末是铁粉的操作顺序是____________。
证明KClO3中含有氯元素的操作顺序是____________。
(2)亚硝酸钠NaNO2可用作水泥施工的抗冻剂。它易溶于水,有碱味,有氧化性,也有还原性。在酸性溶液中它能氧化碘离子、亚铁离子。它能将人体内血红蛋白里所含有亚铁离子氧化为三价铁离子使人中毒,在建筑工地上多次发生把硝酸钠误作食盐使用,导致民工中毒的事件。亚硝酸钠和酸反应应生产亚硝酸,亚硝酸是不稳定的弱酸,它只存于冷的稀溶液中,易发生如下分解反应。3HNO2=2NO↑+HNO3+
H2O从醋酸、氨水、纯碱、稀盐酸、碘化钾淀粉溶液中选择适当的物质做试剂,用两种简单的化学实验方法来鉴别亚硝酸钠和氯化钠。
方法一:试剂是(只用一种试剂)____________;现象:____________。
方法二:实验步骤及实验现象是__________________________________。
对于混合物的分离、提纯、鉴别,常采用的方法有:A.过滤 B.蒸发、冷却、结晶 C.蒸馏 D.萃取 E.丁达尔效应 F.加热分解 H.分液等.下列各组混和物的分离、提纯或鉴别,应采用什么方法(选择正确答案填写到下列空格中,请用字母表示)
(1)除去植物油中含有的水分最好采用 的方法;
(2)用CCl4萃取碘水中的I2后,得到CCl4的I2混合溶液,若需回收混合溶液中的CCl4可采用 的方法;
(3)用食用酒精浸泡中草药提取其中的有效成份可采用 的方法;
(4)区别FeCl3溶液和Fe(OH)3胶体,通过观察两种物质是否具有 来判定.
查看习题详情和答案>>
(1)除去植物油中含有的水分最好采用
(2)用CCl4萃取碘水中的I2后,得到CCl4的I2混合溶液,若需回收混合溶液中的CCl4可采用
(3)用食用酒精浸泡中草药提取其中的有效成份可采用
(4)区别FeCl3溶液和Fe(OH)3胶体,通过观察两种物质是否具有
加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
【问题1】工业生产碘酸钾的流程如下: 
(1)已知步骤①反应器发生的反应中,生成的两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式: 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL
恰好反应完全。则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(3)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡。 | 溶液变蓝色 |
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。 查看习题详情和答案>>
加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
【问题1】工业生产碘酸钾的流程如下:
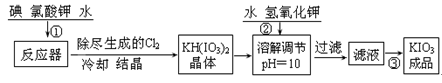
(1)已知步骤①反应器发生的反应中,生成的两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式: 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是 。
【问题2】已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-。
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL
恰好反应完全。则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(3)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。
【问题1】工业生产碘酸钾的流程如下:

(1)已知步骤①反应器发生的反应中,生成的两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式: 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL
恰好反应完全。则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(3)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡。 | 溶液变蓝色 |
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。